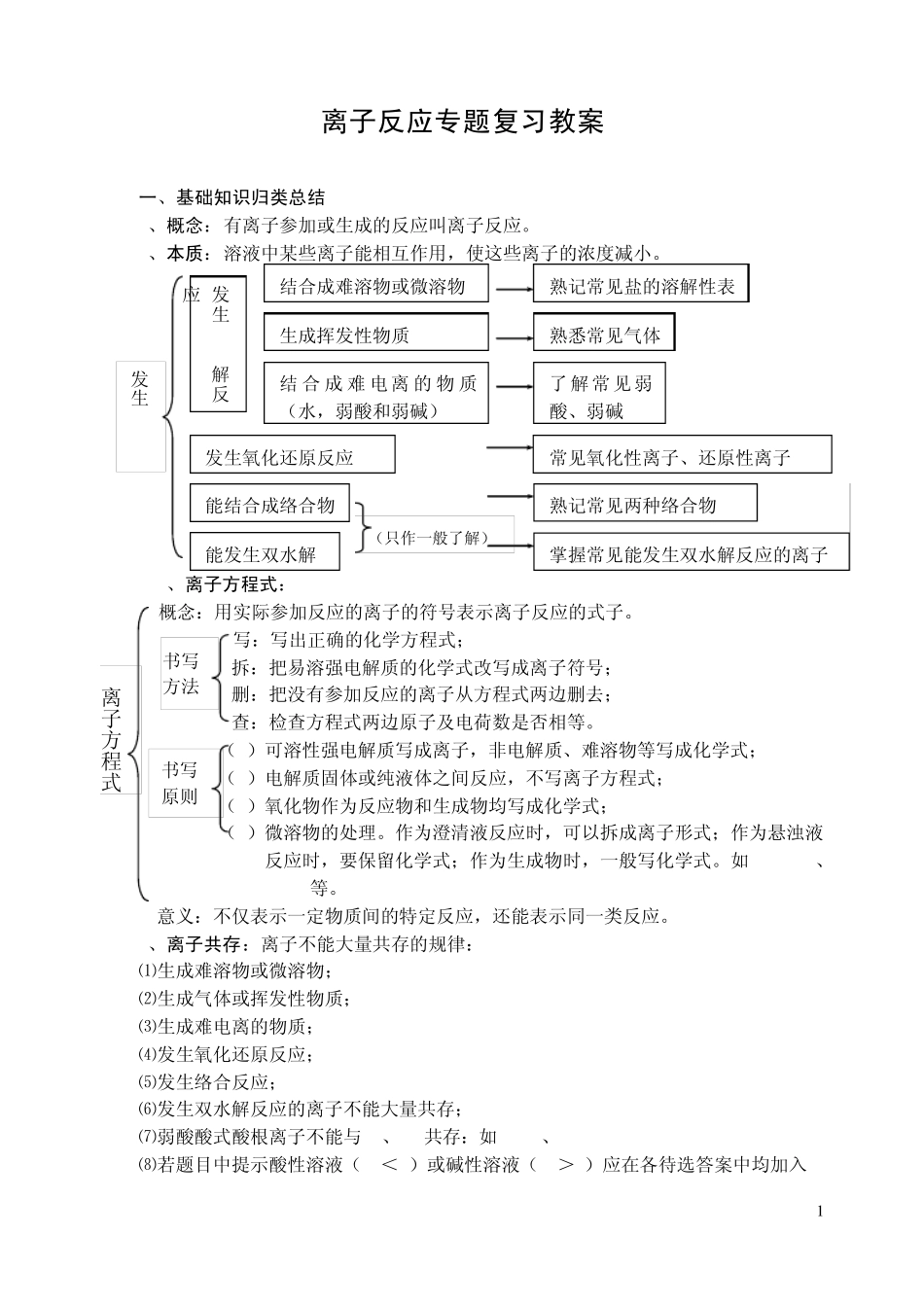
1 离子反应专题复习教案 一、基础知识归类总结 1、概念:有离子参加或生成的反应叫离子反应。 2、本质:溶液中某些离子能相互作用,使这些离子的浓度减小。 3、离子方程式: 概念:用实际参加反应的离子的符号表示离子反应的式子。 写:写出正确的化学方程式; 拆:把易溶强电解质的化学式改写成离子符号; 删:把没有参加反应的离子从方程式两边删去; 查:检查方程式两边原子及电荷数是否相等。 (1)可溶性强电解质写成离子,非电解质、难溶物等写成化学式; (2)电解质固体或纯液体之间反应,不写离子方程式; (3)氧化物作为反应物和生成物均写成化学式; (4)微溶物的处理。作为澄清液反应时,可以拆成离子形式;作为悬浊液反应时,要保留化学式;作为生成物时,一般写化学式。如Ca(OH)2、CaSO4等。 意义:不仅表示一定物质间的特定反应,还能表示同一类反应。 4、离子共存:离子不能大量共存的规律: ⑴生成难溶物或微溶物; ⑵生成气体或挥发性物质; ⑶生成难电离的物质; ⑷发生氧化还原反应; ⑸发生络合反应; ⑹发生双水解反应的离子不能大量共存; ⑺弱酸酸式酸根离子不能与 H+、OH-共存:如HCO3-、HS- ⑻若题目中提示酸性溶液(pH<7)或碱性溶液(pH>7)应在各待选答案中均加入 H+书写 原则 离子方程式 书写 方法 发生条件 结合成难溶物或微溶物 生成挥发性物质 结 合 成难电离的物质(水,弱酸和弱碱) 发生氧化还原反应 能结合成络合物 能发生双水解 熟记常见盐的溶解性表 熟悉常见气体 了解常见弱酸、弱碱 常见氧化性离子、还原性离子 熟记常见两种络合物 掌握常见能发生双水解反应的离子 发生复分解反应(只作一般了解) 2 或OH-后考虑。 ⑼溶液无色透明时,则溶液中肯定没有有色离子。常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等。 5、思维拓展 例1、下列离子方程式中,正确的是( D ) A.向硫酸铁的酸性溶液中通入硫化氢: 2Fe3++S2-==2Fe2++S↓ B.氯气通入冷水中Cl2+ H2O=Cl-+ClO-+2H+ C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH- D.电解饱和食盐水:2Cl-+2H2O电解 H2↑+Cl2↑+2OH- [解析] A项H2S是弱酸,应用化学式表示。B项氯气与水反应生成的HClO是弱酸,应用化学式表示。C项S2-水解应分步进行。 例2.下列反应的离子方程式正确的是( B )。 A.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O B.用氨水吸收过量的二氧...