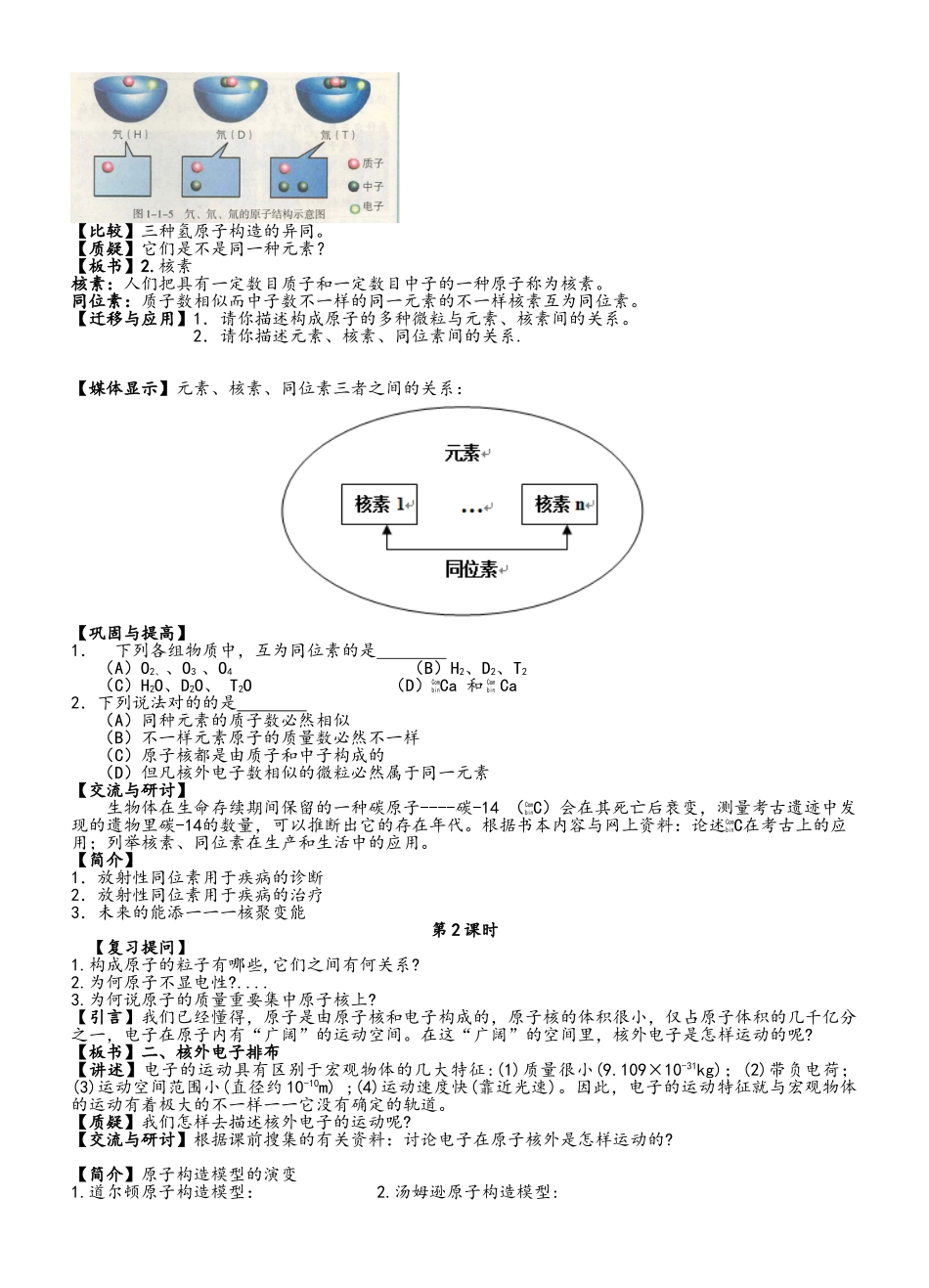
第 1 章 原子构造与元素周期律第一节 原子构造一.教学目的(一) 知识与技能目的1.引导学生认识原子核的构造,懂得质量数和\s\up 6( A)X 的含义,掌握构成原子的微粒间的关系;懂得元素、核素、同位素的涵义;掌握核电荷数、质子数、中子数、质量数之间的互相关系。2.引导学生理解原子核外电子的排布规律,使他们能画出 1~18 号元素的原子构造示意图;理解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系。(二)过程与措施目的通过对构成原子的微粒间的关系和氢元素核素等问题的探讨,培养学生分析、处理数据的能力,尝试运用比较、归纳等措施对信息进行加工。(三)情感态度与价值观目的1.通过构成物质的基本微粒的质量、电性的认识,理解微观世界的物质性,从而深入认识物质世界的微观本质;通过原子中存在电性不一样的两种微粒的关系,认识原子是矛盾的对立统一体。2.通过人类探索原子构造的历史的简介,使学生理解假说、模型等科学研究措施和科学研究的历程,培养他们的科学态度和科学精神,体验科学研究的艰苦与喜悦。3.通过“化学与技术----放射性同位素与医疗”,引导学生关注化学知识在提高人类生活质量中所起的作用。4.通过“未来的能源----核聚变能”,引导他们关注与化学有关的热点问题,形成可持续发展的思想。二.教学重点、难点(一)知识上重点、难点:构成原子的微粒间的关系和核外电子排布规律。(二)措施上重点、难点:培养分析、处理数据的能力,尝试运用比较、归纳等措施对信息进行加工。理解假说、模型等科学研究措施和科学研究的历程。三.教学过程第 1 课时【提问】化学变化中的最小微粒是什么?【学生回答】原子是化学变化中的最小微粒。【引出课题】这一节就从探讨原子的构造开始我们的学习。【板书】第一节 原子构造【提出问题】原子是化学变化中的最小微粒。同种原子的性质和质量都相似。那么原子能不能再分?原子又是怎样构成的呢?【学生思考、回答】【媒体显示】运用 Flash 动画演示卢瑟福的粒子散射试验1.试验示意图2.现象: 【观测、思考】在教师引导下,学生思考下列问题:(1)绝大多数粒子穿过金箔后仍沿本来的方向前进,原因是什么?(2)为何有少数粒子却发生了较大的偏转?(3)很少数的粒子几乎象是被金箔弹了回来,原因是什么? 【讨论】学生分组讨论:根据粒子散射的试验现象,学生提出自己的原子构造模型。并由代表发言。【归纳、小结】3.卢瑟福的原子核式模型原子由原子核...