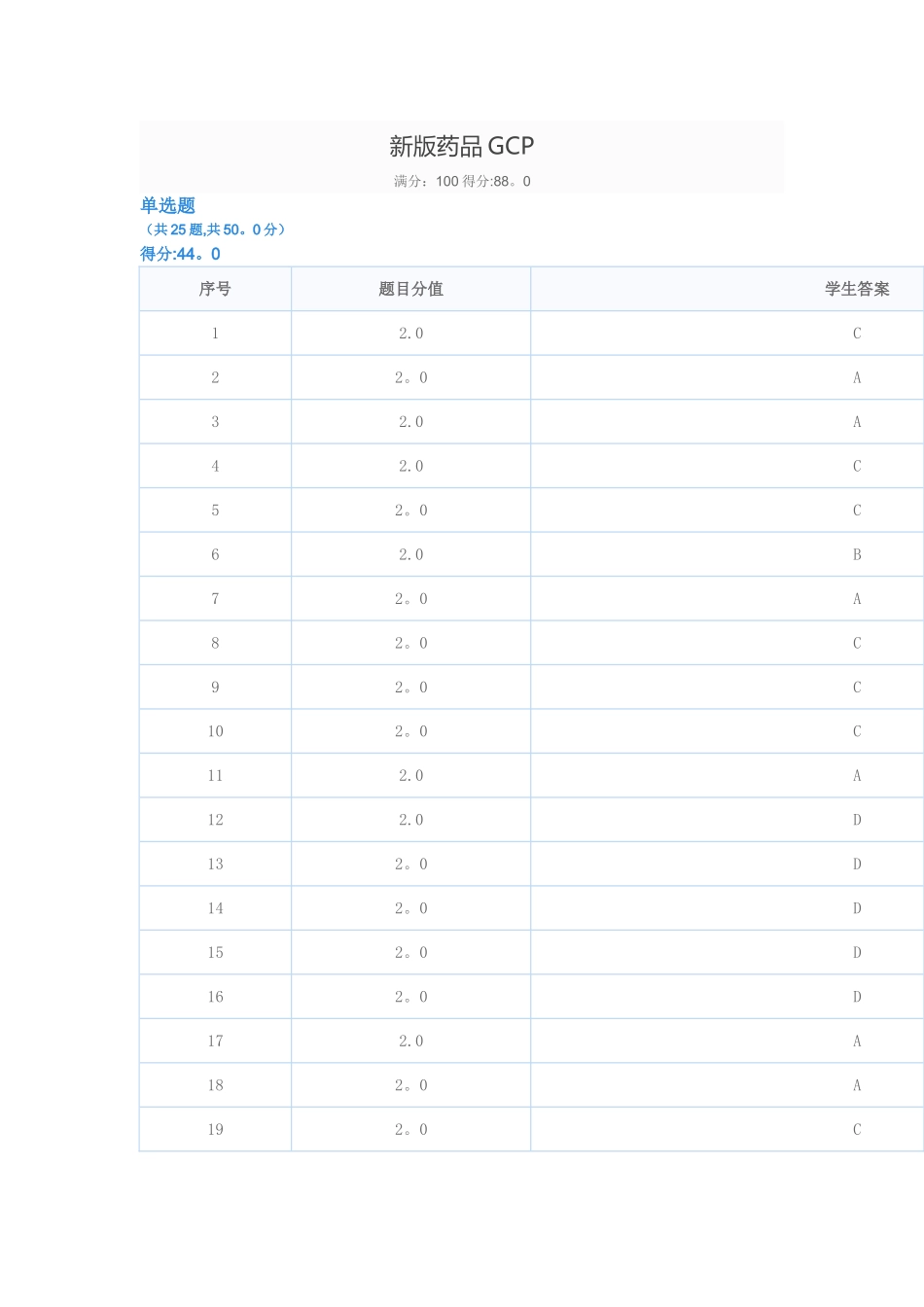
新版药品 GCP满分:100 得分:88。0单选题(共 25 题,共 50。0 分)得分:44。0序号题目分值学生答案12.0C22。0A32.0A42.0C52。0C62.0B72。0A82。0C92。0C102。0C112.0A122.0D132。0D142。0D152。0D162。0D172.0A182。0A192。0C202.0D212。0B222。0B232。0C242。0C252.0C1. 下列哪项不属于讨论者的职责?A.根据申办者提供的指导说明填写和修改病例报告表B.向伦理委员会提交临床试验的年度报告C.处理试验用剩余药品D.监督试验现场的数据采集、各讨论人员履行其工作职责的情况2。 《药物临床试验质量管理法律规范》的目的是什么?A.保证药物临床试验过程法律规范,数据和结果的科学、真实、可靠,保护受试者的权益和安全B.保证药物临床试验在科学上具有先进性C.保证临床试验对受试者无风险D.保证药物临床试验的过程按计划完成3。 临床试验中使一方或者多方不知道受试者治疗分配的程序.A.设盲B.单盲C.随机D.双盲4。 以下哪一项说法不准确:A.讨论者应详细阅读和遵守试验方案B.未经申办者和伦理委员会的同意,讨论者绝对不得修改或者偏离试验方案C.为了消除对受试者的紧急危害,在未获得伦理委员会同意的情况下,讨论者允许修改或者偏离试验方案D.讨论者应当实行措施,避开使用试验方案禁用的合并用药5。 以下哪项不是源数据的特点:A.可归因性B.易读性C.延迟性D.原始性6. 在临床试验质量保证系统中,为确证临床试验所有相关活动是否符合质量要求而实施的技术和活动。A.监查B.质量保证C.稽查D.质量控制7。 受试者接受试验用药品后出现死亡、危及生命、永久或者严重的残疾或者功能丧失、受试者需要住院治疗或者延长住院时间,以及先天性异常或者出生缺陷等不良医学事件。A.严重不良事件B.药品不良反应C.不良事件D.可疑非预期严重不良反应8。 临床试验质量保证和质量控制系统的标准操作规程,以下哪项描述正确且完整:A.申办者负责制定和实施临床试验质量保证和质量控制系统的标准操作规程B.上述标准操作规程确保临床试验的实施、数据的产生和报告均遵守试验方案和相关法律法规的要求C.数据处理的每个阶段均有质量控制,以保证所有数据是可靠的,数据处理过程是正确的D.临床试验和实验室检测的关键过程需严格根据质量管理标准操作规程进行9。 对于生物等效性试验的临床试验用药品,临床试验机构至少保存留样多久?A.至试验结束后 2 年B.至试验结束后 5 年C.至药品上市后 2 年D.至药品上市后 5 年10...