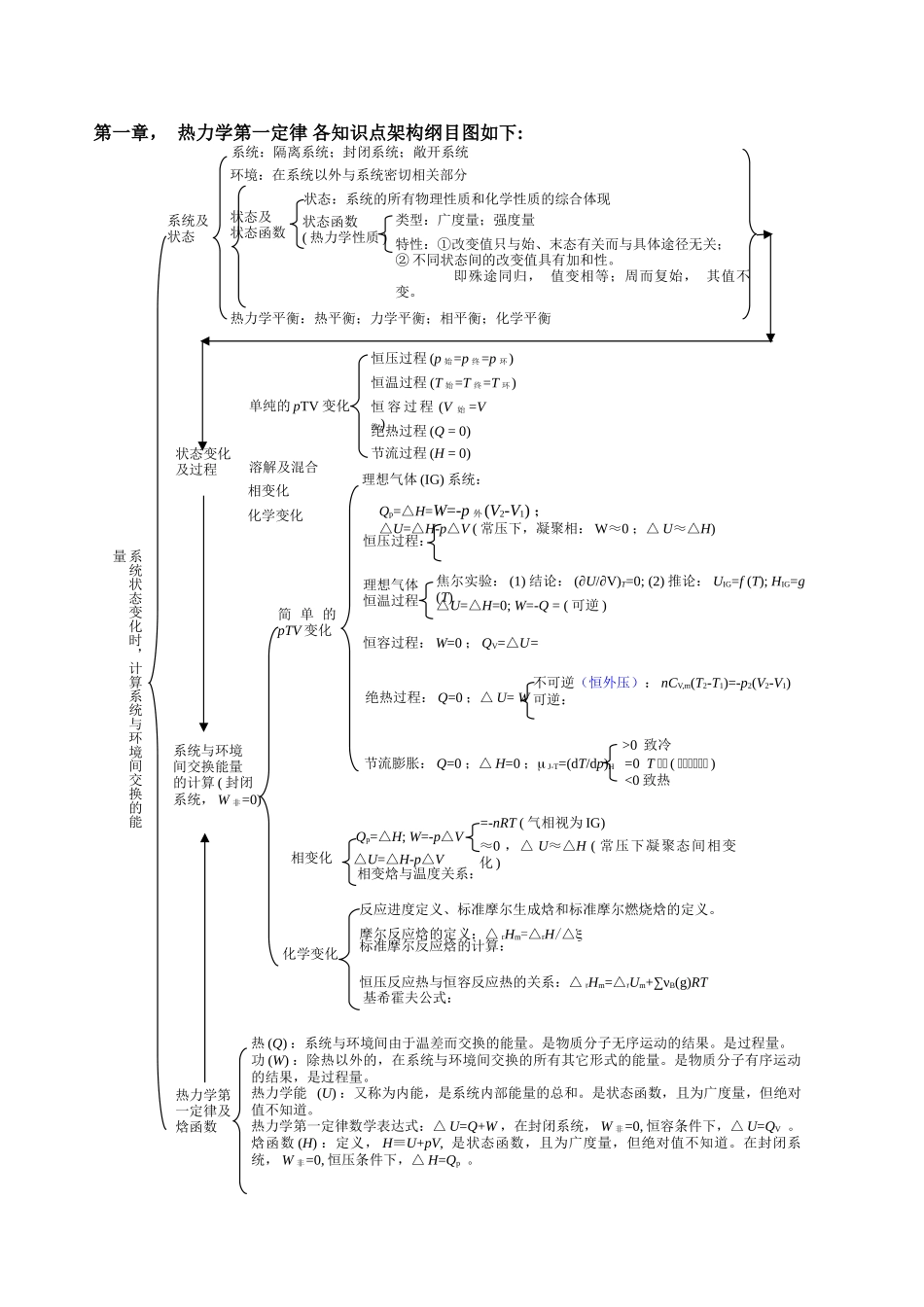
第一章, 热力学第一定律 各知识点架构纲目图如下:状态变化及过程溶解及混合化学变化相变化单纯的 pTV 变化恒 容 过 程 (V 始 =V终)恒温过程 (T 始=T 终=T 环) 恒压过程 (p 始=p 终=p 环)绝热过程 (Q = 0)节流过程 (H = 0)系统及状态环境:在系统以外与系统密切相关部分系统:隔离系统;封闭系统;敞开系统状态及状态函数状态:系统的所有物理性质和化学性质的综合体现类型:广度量;强度量特性:①改变值只与始、末态有关而与具体途径无关;② 不同状态间的改变值具有加和性。 即殊途同归, 值变相等;周而复始, 其值不变。状态函数( 热力学性质 )热力学平衡:热平衡;力学平衡;相平衡;化学平衡热 (Q) :系统与环境间由于温差而交换的能量。是物质分子无序运动的结果。是过程量。功 (W) :除热以外的,在系统与环境间交换的所有其它形式的能量。是物质分子有序运动的结果,是过程量。热力学能 (U) :又称为内能,是系统内部能量的总和。是状态函数,且为广度量,但绝对值不知道。热力学第一定律数学表达式:△ U=Q+W ,在封闭系统, W 非=0, 恒容条件下,△ U=QV 。焓函数 (H) :定义, H≡U+pV, 是状态函数,且为广度量,但绝对值不知道。在封闭系统, W 非=0, 恒压条件下,△ H=Qp 。热力学第一定律及焓函数系统与环境间交换能量的计算 ( 封闭系统, W 非=0)简 单 的pTV 变化理想气体 (IG) 系统:理想气体恒温过程焦尔实验: (1) 结论: (∂U/∂V)T=0; (2) 推论: UIG=f (T); HIG=g (T)△U=△H=0; W=-Q = ( 可逆 )恒容过程: W=0 ; QV=△U= 绝热过程: Q=0 ;△ U= W不可逆(恒外压): nCV,m(T2-T1)=-p2(V2-V1)可逆: Qp=△H=W=-p 外(V2-V1) ;△U=△H-p△V ( 常压下,凝聚相: W≈0 ;△ U≈△H)恒压过程:节流膨胀: Q=0 ;△ H=0 ; J-T=(dT/dp)H =0 T 不不 ( 不不不不不不 )<0 致热>0 致冷相变化△U=△H-p△VQp=△H; W=-p△V≈0 ,△ U≈△H ( 常压下凝聚态间相变化 )=-nRT ( 气相视为 IG)相变焓与温度关系:化学变化摩尔反应焓的定义:△ rHm=△rH/△恒压反应热与恒容反应热的关系:△ rHm=△rUm+∑νB(g)RT标准摩尔反应焓的计算:反应进度定义、标准摩尔生成焓和标准摩尔燃烧焓的定义。基希霍夫公式:系统状态变化时,计算系统与环境间交换的能量