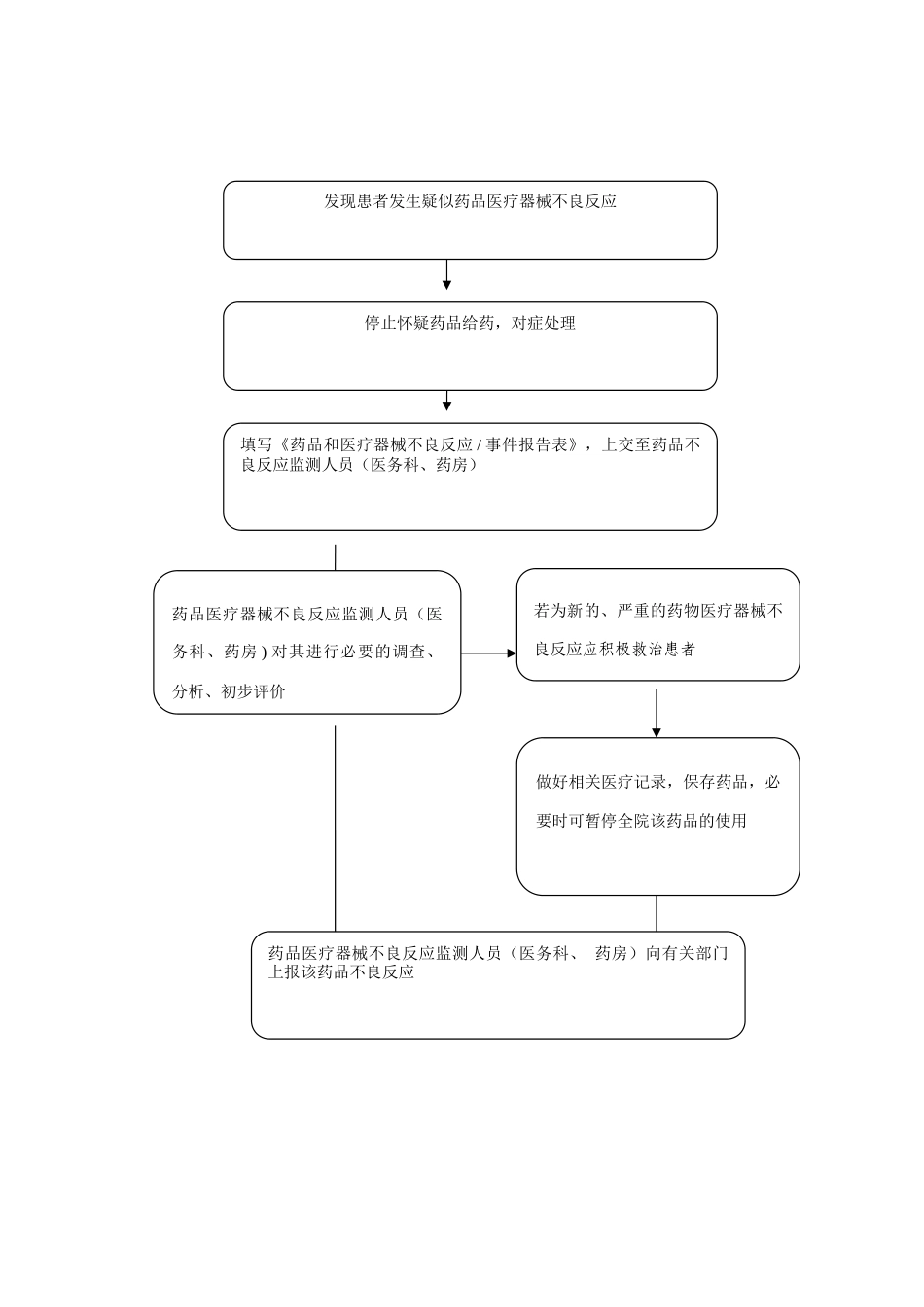
药品及医疗器械不良反应监测报告制度和流程加强药品和医疗器械的安全监管,严格药品和医疗器械不良反应监测工作的管理,确保人体用药安全有效,依据《中华人民共和国药品管理法》及《药品不良反应监测与报告管理办法》,结合本院实际,特制定本制度。一、各临床科室主任为药品和医疗器械不良反应监测工作的管理人员,负责本科室使用的药品和医疗器械的不良反应情况监测、收集、报告和管理工作.医务科、药房负责全院药品不良反应的监测、收集、报告管理工作。二、报告范围:药品和医疗器械不良反应报告的范围为药品和医疗器械引起的所有可疑不良反应。三、 报告及处理程序本院对所使用的药品和医疗器械的不良反应情况进行监测各岗位(医生、护士、药师)要积极配合做好药品和医疗器械不良反应监测工作,一经发现可疑药品不良反应,应当立即向科主任汇报,填写《药品不良反应/事件报告表》(见附表),并报告至医院药品和医疗器械不良反应监测员(医务科、药房),然后逐级上报.此外,对于新的、严重的不良反应应积极救治患者,做好医疗记录,保存好相关药品、物品的留样,分析查找问题,将损害降至最低。 本院发现可疑药品和医疗器械不良反应群体病例,应当积极救治患者,迅速开展临床调查,分析事件发生的原因,必要时可实行暂停药品的使用等紧急措施,立即向当地药品监督管理部门报告,同时填写《药品群体不良事件基本信息表》(见附表3)。 发现药品和医疗器械说明书中未载明的可疑严重不良反应病例应当在 15 日内报告,其中死亡病例须立即报告.其他药品不良反应应当在 30 日内报告。有随访信息的,应当及时报告. 发现非本院所使用的药品引起的可疑药品不良反应,发现者可直接向当地药品监督管理部门报告。 经核实确认某批号药品发现不良反应或药品监督管理部门已确认有药品不良反应的药品,单位药品质量负责人应立即通知仓库管理员,停止该批号药品发出,就地封存,并及时追回已发出的药品等紧急控制措施.四、未经当地药品监督管理部门允许的药品不良反应监测资料,任何单位和个人不得向国内外机构、组织、学术团体或个人提供。五、 对新发现的、严重的药品和医疗器械不良反应应进行重点监测,进一步了解药品的临床使用和不良反应发生情况,讨论不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。六、医院鼓舞各科室积极及时上报药品不良反应,其上报情况纳入科室评先评优的指标之一。七、定义: 药品和医疗器械不良反应,是指合格...