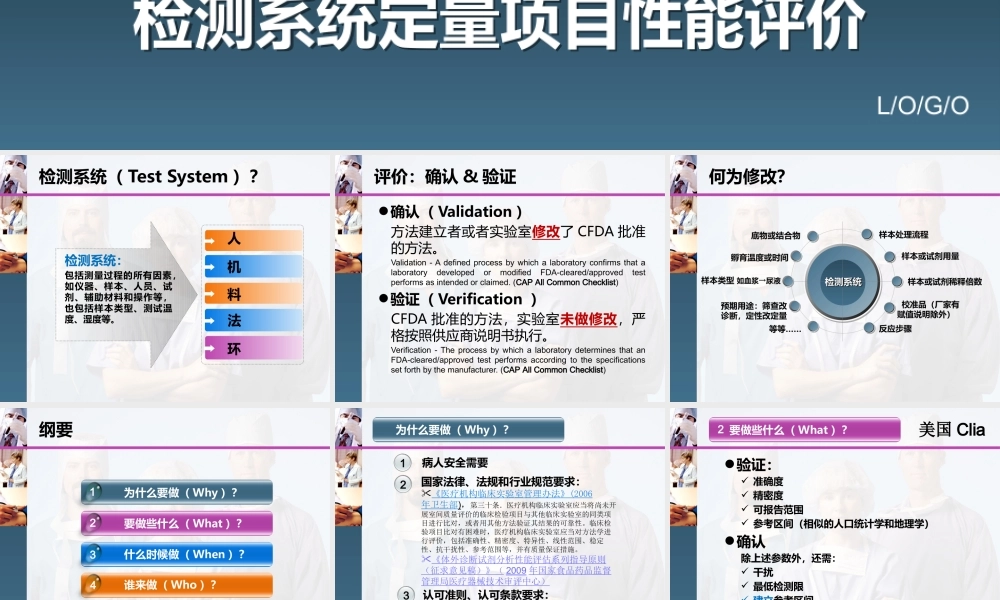
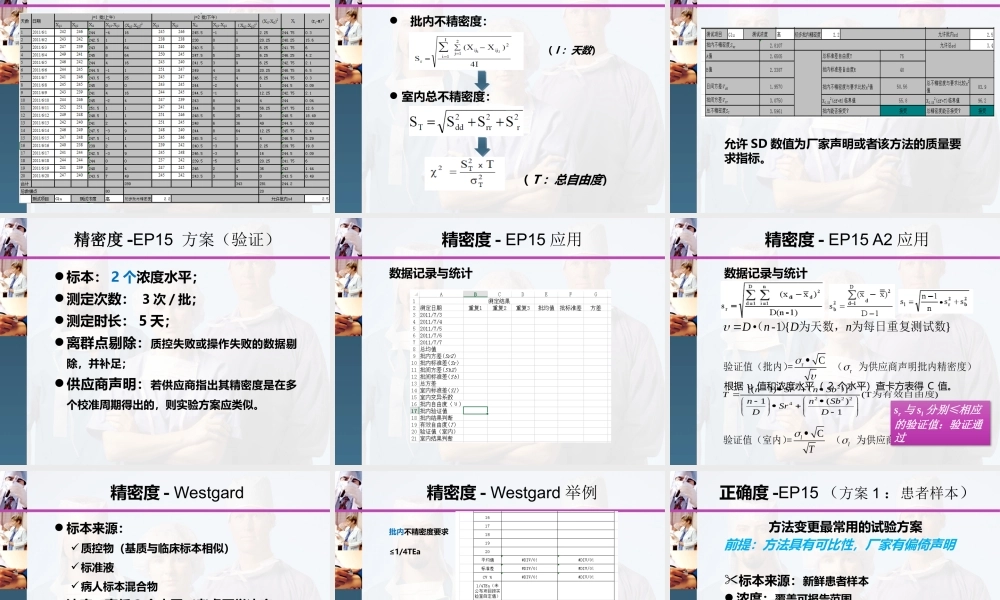
L/O/G/O检测系统定量项目性能评价检测系统定量项目性能评价检测系统( Test System )?检测系统:包括测量过程的所有因素,如仪器、样本、人员、试剂、辅助材料和操作等,也包括样本类型、测试温度、湿度等。人机料法环评价:确认 & 验证确认( Validation )方法建立者或者实验室修改了 CFDA 批准的方法。Validation - A defined process by which a laboratory confirms that a laboratory developed or modified FDA-cleared/approved test performs as intended or claimed. (CAP All Common Checklist)验证( Verification )CFDA 批准的方法,实验室未做修改,严格按照供应商说明书执行。Verification - The process by which a laboratory determines that an FDA-cleared/approved test performs according to the specifications set forth by the manufacturer. (CAP All Common Checklist)何为修改? 样本处理流程 样本或试剂稀释倍数 样本或试剂用量 校准品(厂家有赋值说明除外) 反应步骤检测系统检测系统 底物或结合物等等……样本类型 如血浆→尿液预期用途:筛查改诊断,定性改定量孵育温度或时间纲要为什么要做( Why )? 要做些什么( What )?什么时候做( When )? 谁来做( Who )?4123怎么做( How )?51病人安全需要国家法律、法规和行业规范要求:《医疗机构临床实验室管理办法》(2006年卫生部),第三十条.医疗机构临床实验室应当将尚未开展室间质量评价的临床检验项目与其他临床实验室的同类项目进行比对,或者用其他方法验证其结果的可靠性。临床检验项目比对有困难时,医疗机构临床实验室应当对方法学进行评价,包括准确性、精密度、特异性、线性范围、稳定性、抗干扰性、参考范围等,并有质量保证措施。《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》( 2009 年国家食品药品监督管理局医疗器械技术审评中心)认可准则、认可条款要求:CNAS-CL02 : 2008 5.5.2 ,实验室应只用确认过的程序证实所用检验程序适合其预期用途,证实应尽量充分以满足给定用途或满足某领域应用的需求。实验室应记录证实所得的结果及使用的程序。为什么要做( Why )? 23美国 Clia验证: 准确度 精密度 可报告范围 参考区间(相似的人口统计学和地理学)确认除上述参数外,还需: 干扰 最低...