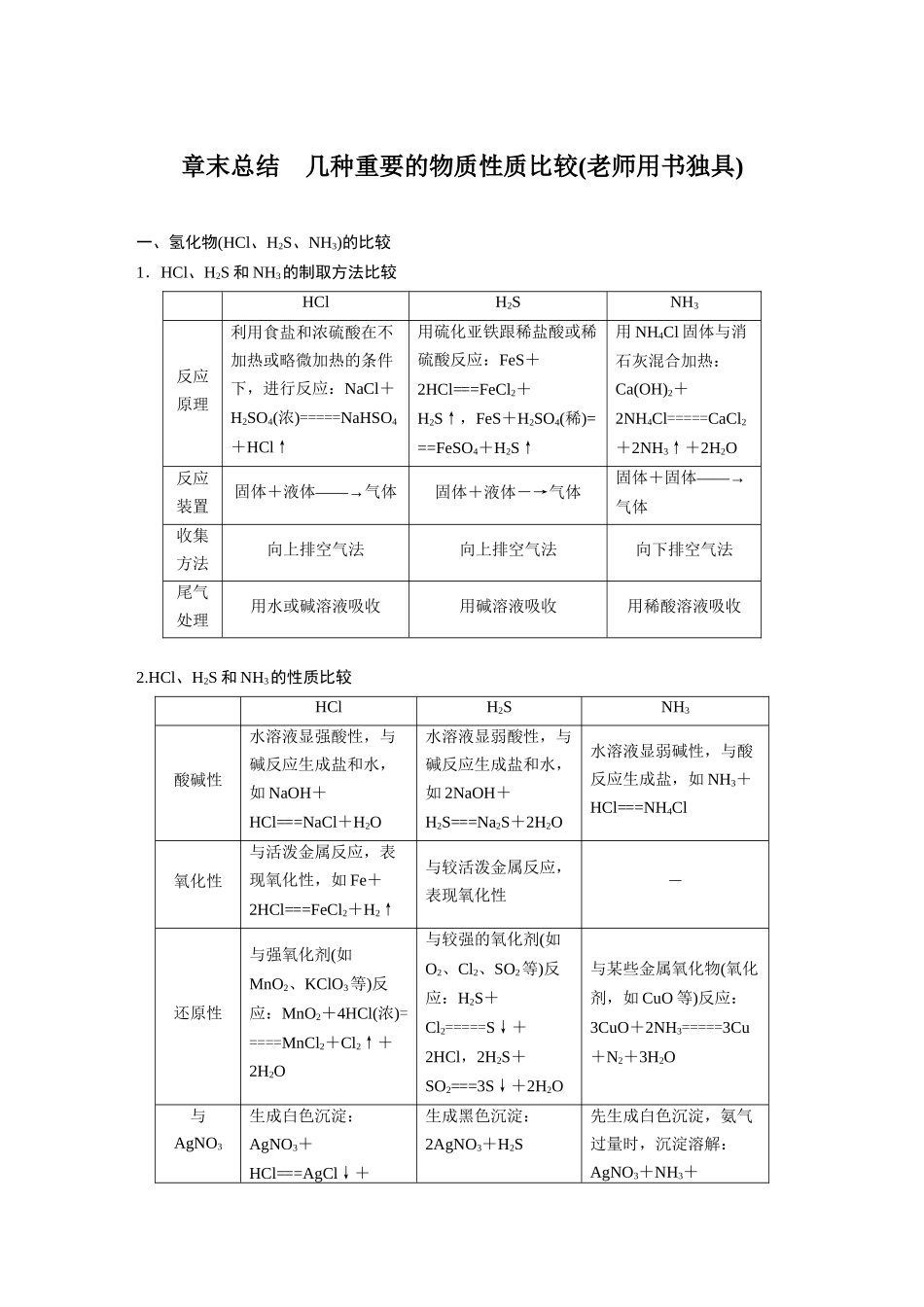
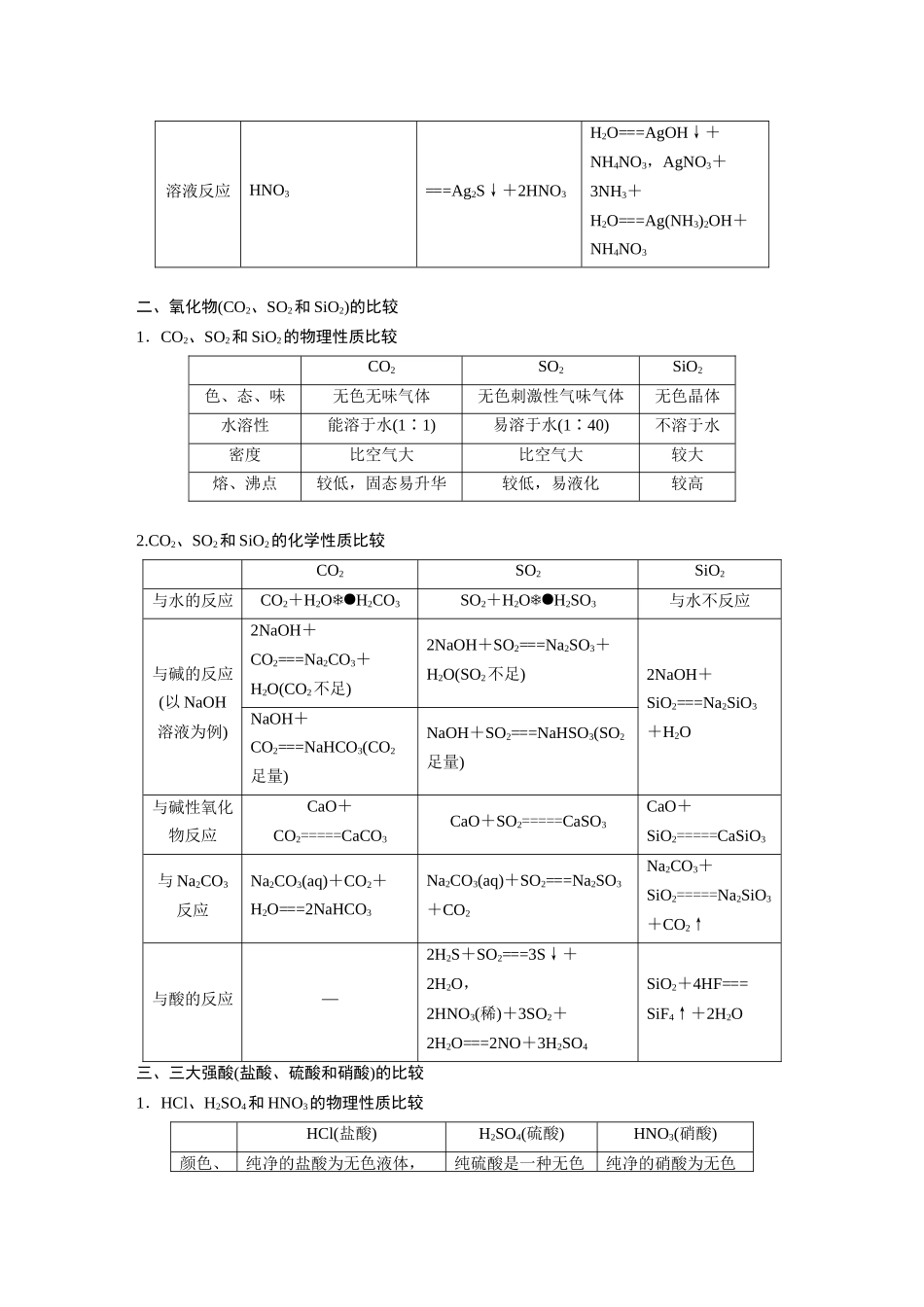
章末总结 几种重要的物质性质比较(老师用书独具)一、氢化物(HCl、H2S、NH3)的比较1.HCl、H2S 和 NH3的制取方法比较HClH2SNH3反应原理利用食盐和浓硫酸在不加热或略微加热的条件下,进行反应:NaCl+H2SO4(浓)=====NaHSO4+HCl↑用硫化亚铁跟稀盐酸或稀硫酸反应:FeS+2HCl===FeCl2+H2S↑,FeS+H2SO4(稀)===FeSO4+H2S↑用 NH4Cl 固体与消石灰混合加热:Ca(OH)2+2NH4Cl=====CaCl2+2NH3↑+2H2O反应装置固体+液体――→气体固体+液体―→气体固体+固体――→气体收集方法向上排空气法向上排空气法向下排空气法尾气处理用水或碱溶液吸收用碱溶液吸收用稀酸溶液吸收2.HCl、H2S 和 NH3的性质比较HClH2SNH3酸碱性水溶液显强酸性,与碱反应生成盐和水,如 NaOH+HCl===NaCl+H2O水溶液显弱酸性,与碱反应生成盐和水,如 2NaOH+H2S===Na2S+2H2O水溶液显弱碱性,与酸反应生成盐,如 NH3+HCl===NH4Cl氧化性与活泼金属反应,表现氧化性,如 Fe+2HCl===FeCl2+H2↑与较活泼金属反应,表现氧化性-还原性与强氧化剂(如MnO2、KClO3等)反应:MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O与较强的氧化剂(如O2、Cl2、SO2等)反应:H2S+Cl2=====S↓+2HCl,2H2S+SO2===3S↓+2H2O与某些金属氧化物(氧化剂,如 CuO 等)反应:3CuO+2NH3=====3Cu+N2+3H2O与AgNO3生成白色沉淀:AgNO3+HCl===AgCl↓+生成黑色沉淀:2AgNO3+H2S先生成白色沉淀,氨气过量时,沉淀溶解:AgNO3+NH3+溶液反应HNO3===Ag2S↓+2HNO3H2O===AgOH↓+NH4NO3,AgNO3+3NH3+H2O===Ag(NH3)2OH+NH4NO3二、氧化物(CO2、SO2和 SiO2)的比较1.CO2、SO2和 SiO2的物理性质比较CO2SO2SiO2色、态、味无色无味气体无色刺激性气味气体无色晶体水溶性能溶于水(1∶1)易溶于水(1∶40)不溶于水密度比空气大比空气大较大熔、沸点较低,固态易升华较低,易液化较高2.CO2、SO2和 SiO2的化学性质比较CO2SO2SiO2与水的反应CO2+H2OH2CO3SO2+H2OH2SO3与水不反应与碱的反应(以 NaOH溶液为例)2NaOH+CO2===Na2CO3+H2O(CO2不足)2NaOH+SO2===Na2SO3+H2O(SO2不足)2NaOH+SiO2===Na2SiO3+H2ONaOH+CO2===NaHCO3(CO2足量)NaOH+SO2===NaHSO3(SO2足量)与碱性氧化物反应CaO+CO2=====CaCO3CaO+SO2=====CaSO3CaO+SiO2=====CaSiO3与 Na2CO3反应Na2CO3(aq)+CO2+H2O===2NaHCO3Na2CO3(aq)+SO2===Na2SO3+CO2Na2CO3+SiO2=====Na2SiO3+CO2↑与酸的反应—2H2S+SO2===3S↓+2H2O,2HNO...