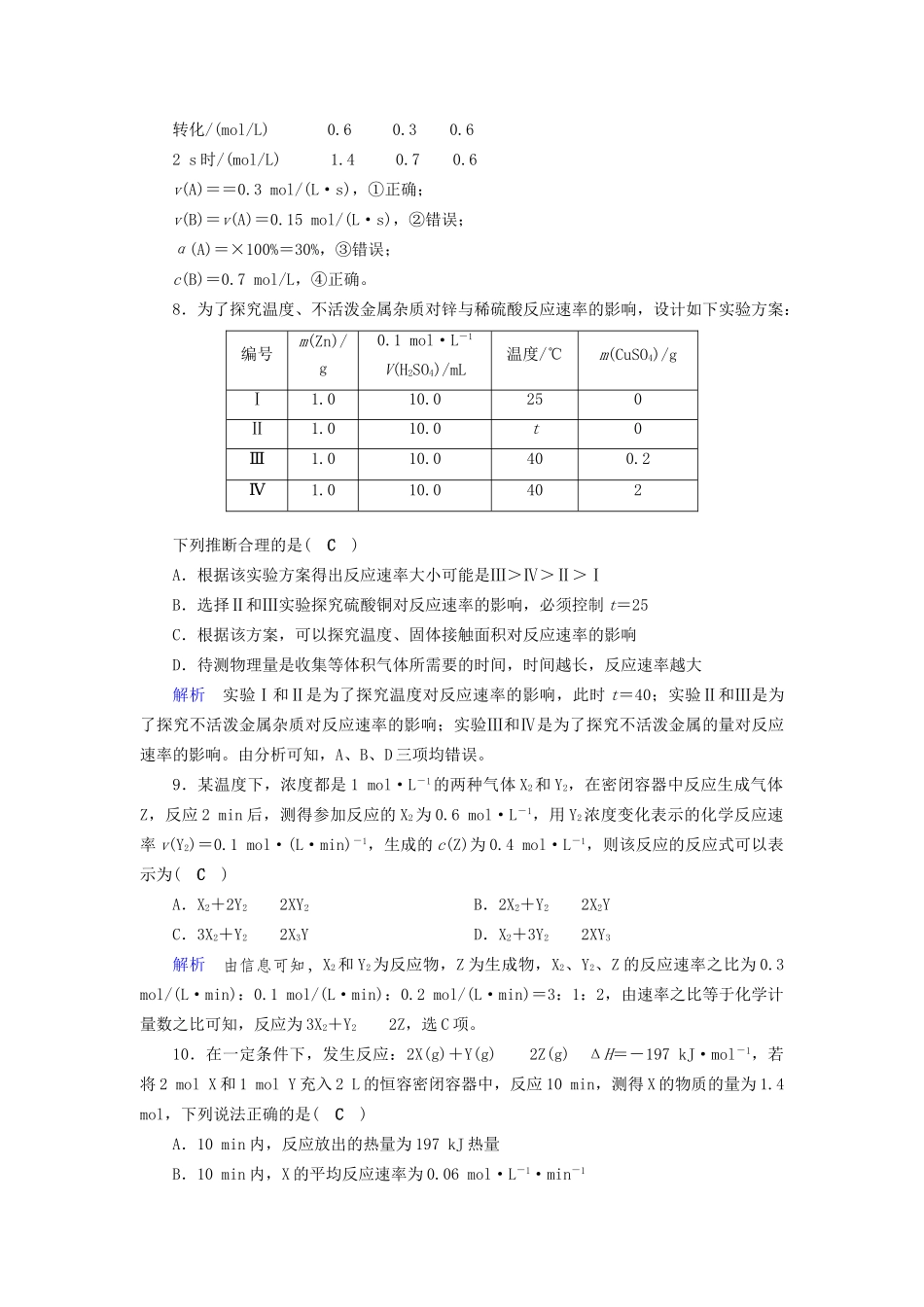
课时达标第25讲1.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的(A)①NaOH固体②H2O③NH4Cl固体④CH3COONa固体⑤NaNO3固体⑥KCl溶液A.②④⑥B.①②C.②③⑤D.②④⑤⑥2.对A(g)+3B(g)===2C(g)+2D(g)来说,下列四种不同情况下的反应速率最快的是(A)A.v(A)=0.005mol/(L·s)B.v(B)=0.6mol/(L·min)C.v(C)=0.5mol/(L·min)D.v(D)=0.45mol/(L·min)解析A项中v(A)=0.005mol/(L·s)的单位转化为mol/(L·min),得到v(A)=0.3mol/(L·min),再将其他选项中用各物质表示的反应速率全部转化为用A表示,B项转化为v(A)=0.2mol/(L·min),C项转化为v(A)=0.25mol/(L·min),D项转化为v(A)=0.225mol/(L·min),故A项表示的反应速率最快,正确。3.对于在一密闭容器中进行的反应C(s)+O2(g)===CO2(g),下列说法错误的是(D)A.将木炭粉碎成粉末状可以加快化学反应速率B.升高温度可以加快化学反应速率C.增加压强可以加快化学反应速率D.增加木炭的量可以加快化学反应速率解析固体或纯液体的浓度视为常数,因此增加木炭的量,反应速率不加快,D项错误。4.温度不变,在恒容的容器中进行下列反应:N2O4(g)2NO2(g)。若N2O4的浓度由0.1mol/L降到0.07mol/L需要15s,那么N2O4的浓度由0.07mol/L降到0.05mol/L,所需反应的时间(A)A.大于10sB.等于10sC.等于5sD.小于10s解析设需要的时间为t。由于反应物的浓度是逐渐降低的,因此反应速率也是逐渐降低的,即(0.1mol/L-0.07mol/L)÷15s>(0.07mol/L-0.05mol/L)÷t,解得t>10s。5.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是(D)实验反应Na2S2O3溶液稀H2SO4H2O温度/℃V/mLc/(mol·L-1)V/mLc/(mol·L-1)V/mLA2550.1100.15B2550.250.210C3550.1100.15D3550.250.210解析四个实验分别混合后硫酸的浓度都相同,A与C实验Na2S2O3浓度相同,B与D实验Na2S2O3浓度相同,且前者小于后者,而实验D比实验B温度高,故实验D反应速率快,最先出现浑浊。6.某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2ONH4HCO3+NH3·H2O。测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是(C)A.0~12min,初始浓度越大的实验,水解反应速率越大B.c(NH2COO-)将随反应时间的不断延长而不断减小C.25℃时,0~6min,v(NH2COO-)为0.05mol·L-1·min-1D.15℃时,第30min时,c(NH2COO-)为2.0mol·L-1解析25℃时v(NH2COO-)=mol·L-1·min-1=0.05mol·L-1·min-1,C项正确。7.将4molA气体和2molB气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol/(L·s)②用物质B表示的反应的平均速率为0.6mol/(L·s)③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol/L其中正确的是(B)A.①③B.①④C.②③D.③④解析2A(g)+B(g)2C(g)起始/(mol/L)210转化/(mol/L)0.60.30.62s时/(mol/L)1.40.70.6v(A)==0.3mol/(L·s),①正确;v(B)=v(A)=0.15mol/(L·s),②错误;α(A)=×100%=30%,③错误;c(B)=0.7mol/L,④正确。8.为了探究温度、不活泼金属杂质对锌与稀硫酸反应速率的影响,设计如下实验方案:编号m(Zn)/g0.1mol·L-1V(H2SO4)/mL温度/℃m(CuSO4)/gⅠ1.010.0250Ⅱ1.010.0t0Ⅲ1.010.0400.2Ⅳ1.010.0402下列推断合理的是(C)A.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅳ>Ⅱ>ⅠB.选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25C.根据该方案,可以探究温度、固体接触面积对反应速率的影响D.待测物理量是收集等体积气体所需要的时间,时间越长,反应速率越大解析实验Ⅰ和Ⅱ是为了探究温度对反应速率的影响,此时t=40;实验Ⅱ和Ⅲ是为了探究不活泼金属杂质对反应速率的影响;实验Ⅲ和Ⅳ是为了探究不活泼金属的量对反应速率的影响。由分析可知,A、B、D三项均错误。9.某温度下,浓度都是1mol·L-1...