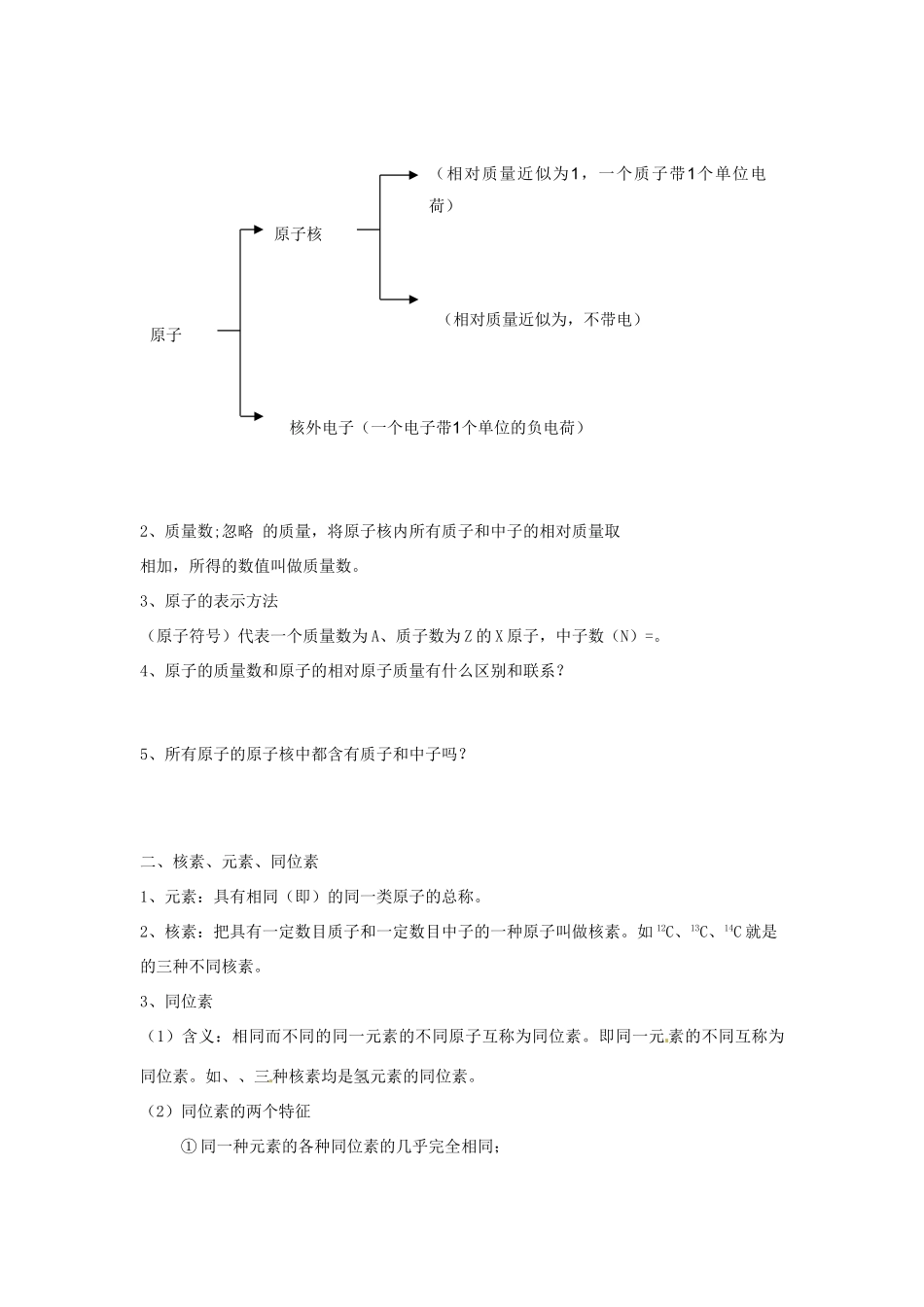
核素学习目标1、 熟练掌握原子的构成和原子各构成微粒间的数量关系,提高数据的分析、处理能力。2、 自主学习,合作探究元素、核素、同位素的区别以及应用原子结构知识解题的方法。3、 全力以赴,激情投入,体会化学微观世界的奇妙与和谐。重点:元素、核素、同位素的辨析。难点:原子中各构成微粒间数量关系的计算。课前预习使用说明与学法指导1、 依据预习案通读教材,进行知识梳理;熟练掌握元素、核素、同位素的区别与联系。2、 认真完成预习自测,将 预习中不能解决的问题标记出来,并填写到后面“课后反思”处。3、 利用 15 分钟高效完成。知识准备1、 什么是元素?你知道哪些元素?2、 物质是由什么构成的?构成物质的原子具有什么样的结构?3、 你知道原子结构的探索过程吗?有哪些科学家作出了贡献?他们设计的原子结构模型是什么样子的?教材助读一、原子的构成及其表示方法1、 原子的构成2、质量数;忽略 的质量,将原子核内所有质子和中子的相对质量取相加,所得的数值叫做质量数。3、原子的表示方法(原子符号)代表一个质量数为 A、质子数为 Z 的 X 原子,中子数(N)=。4、原子的质量数和原子的相对原子质量有什么区别和联系?5、所有原子的原子核中都含有质子和中子吗?二、核素、元素、同位素1、元素:具有相同(即)的同一类原子的总称。2、核素:把具有一定数目质子和一定数目中子的一种原子叫做核素。如 12C、13C、14C 就是的三种不同核素。3、同位素(1)含义:相同而不同的同一元素的不同原子互称为同位素。即同一元 素的不同互称为同位素。如、、三种核素均是氢元素的同位素。(2)同位素的两个特征① 同一种元素的各种同位素的几乎完全相同;原子核核外电子(一个电子带1个单位的负电荷)(相对质量近似为1,一个质子带1个单位电荷)(相对质量近似为,不带电)原子② 在天然存在的某种元素里,不论是游离态还是化合态,同位素之间保持一定的比例,即各种同位素所占的是不变的。(3)同位素的用途 ① 在考古工作中用于测定文物的年代; ② 用于制造氢弹; ③ 利用放射性同位素释放的射线。4、由不同种原子构成的纯净物一定是化合物吗?预习自测1、美国科学家将两种元素铅和氪的原子对撞,获得了一种质子数为 118、中子数为 175 的超重元素,该元素原子核内的中子数与核外电子数之差是( ) A、57 B、47 C、61 D、2832、下列各组微粒中,互为同位素的是( ) A、 B、CO D3、下列说...