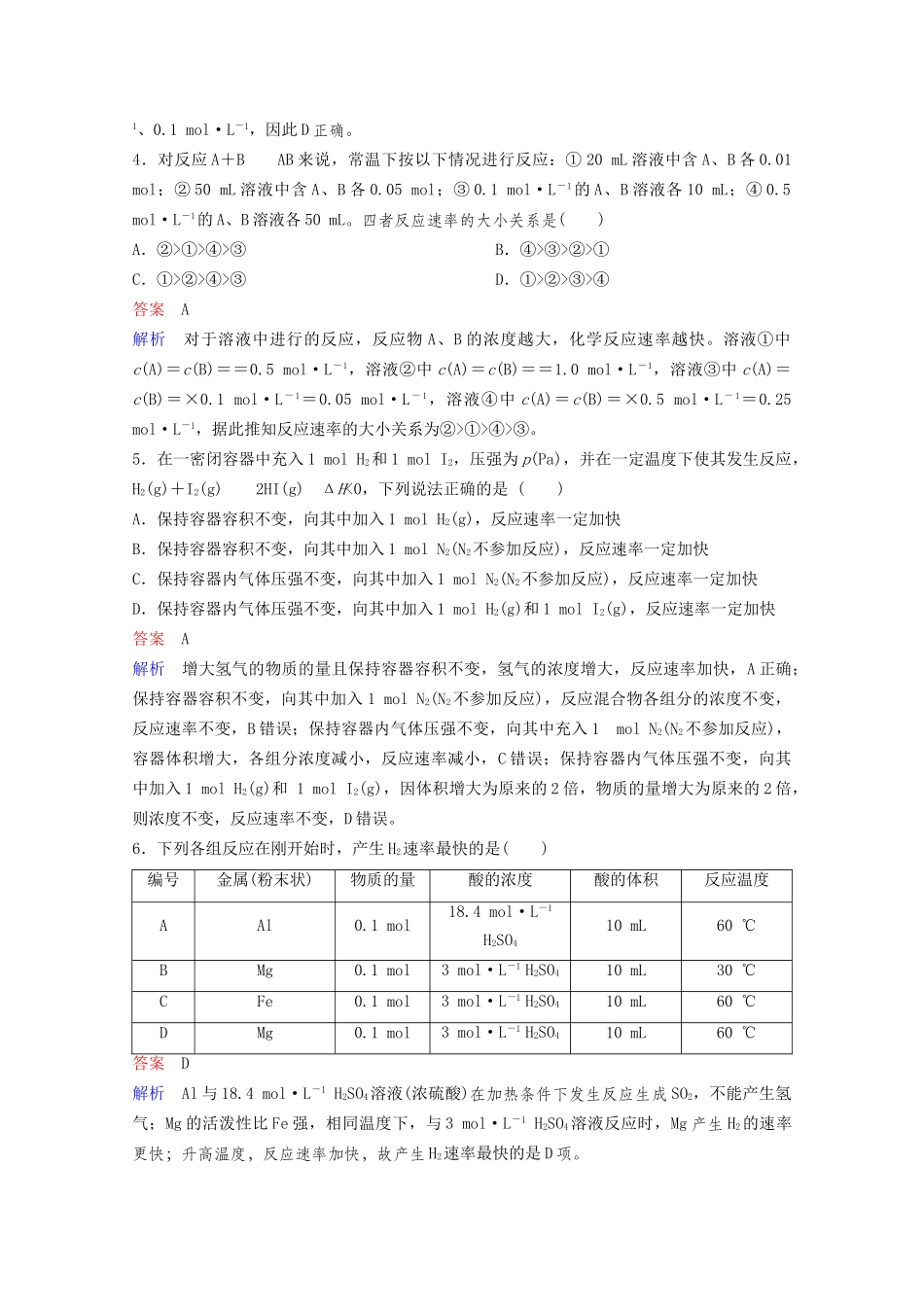
第1节化学反应速率时间:45分钟满分:100分一、选择题(每题7分,共70分)1.一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2+3H22NH3,2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是()A.v(N2)=0.25mol/(L·min)B.v(H2)=0.75mol/(L·min)C.v(NH3)=1mol/(L·min)D.v(NH3)=0.5mol/(L·min)答案C2.(2019·湖南永州高三模拟)下列说法正确的是()A.增大反应物浓度,能增大活化分子百分数,所以反应速率增大B.使用合适的催化剂,能增大活化分子百分数,所以反应速率增大C.对于任何反应,增大压强都可加快反应速率D.升高温度,只能增大吸热反应的反应速率答案B解析增大反应物的浓度会增大单位体积的活化分子数,但活化分子的百分数不变,A错误;使用合适的催化剂,降低反应的活化能,使部分不是活化分子的分子成为活化分子,增大活化分子百分数,所以反应速率增大,B正确;对于只有固态或液态物质参与的化学反应,增大压强,对反应速率无影响,C错误;升高温度,吸热、放热反应的速率都增大,D错误。3.如图所示为800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是()A.发生的反应可表示为2A(g)2B(g)+C(g)B.前2minA的分解速率为0.1mol·L-1·min-1C.开始时,正、逆反应同时开始D.2min时,A、B、C的浓度之比为2∶3∶1答案C解析根据图像,反应过程中A的浓度减小,B、C浓度增大,因此A为反应物,B、C为生成物,根据浓度的变化量可以确定反应为2A(g)2B(g)+C(g),A正确;前2min,v(A)==0.1mol·L-1·min-1,B正确;开始时加入的物质为A和B,没有C,正、逆反应不是同时开始,C错误;根据图像,2min时,A、B、C的浓度分别为0.2mol·L-1、0.3mol·L-1、0.1mol·L-1,因此D正确。4.对反应A+BAB来说,常温下按以下情况进行反应:①20mL溶液中含A、B各0.01mol;②50mL溶液中含A、B各0.05mol;③0.1mol·L-1的A、B溶液各10mL;④0.5mol·L-1的A、B溶液各50mL。四者反应速率的大小关系是()A.②>①>④>③B.④>③>②>①C.①>②>④>③D.①>②>③>④答案A解析对于溶液中进行的反应,反应物A、B的浓度越大,化学反应速率越快。溶液①中c(A)=c(B)==0.5mol·L-1,溶液②中c(A)=c(B)==1.0mol·L-1,溶液③中c(A)=c(B)=×0.1mol·L-1=0.05mol·L-1,溶液④中c(A)=c(B)=×0.5mol·L-1=0.25mol·L-1,据此推知反应速率的大小关系为②>①>④>③。5.在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)2HI(g)ΔH<0,下列说法正确的是()A.保持容器容积不变,向其中加入1molH2(g),反应速率一定加快B.保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率一定加快C.保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率一定加快D.保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率一定加快答案A解析增大氢气的物质的量且保持容器容积不变,氢气的浓度增大,反应速率加快,A正确;保持容器容积不变,向其中加入1molN2(N2不参加反应),反应混合物各组分的浓度不变,反应速率不变,B错误;保持容器内气体压强不变,向其中充入1molN2(N2不参加反应),容器体积增大,各组分浓度减小,反应速率减小,C错误;保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),因体积增大为原来的2倍,物质的量增大为原来的2倍,则浓度不变,反应速率不变,D错误。6.下列各组反应在刚开始时,产生H2速率最快的是()编号金属(粉末状)物质的量酸的浓度酸的体积反应温度AAl0.1mol18.4mol·L-1H2SO410mL60℃BMg0.1mol3mol·L-1H2SO410mL30℃CFe0.1mol3mol·L-1H2SO410mL60℃DMg0.1mol3mol·L-1H2SO410mL60℃答案D解析Al与18.4mol·L-1H2SO4溶液(浓硫酸)在加热条件下发生反应生成SO2,不能产生氢气;Mg的活泼性比Fe强,相同温度下,与3mol·L-1H2SO4溶液反应时,Mg产生H2的速率更快;升高温度,反应速率加快,故产生H2速率最快的是D项。7.将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应...