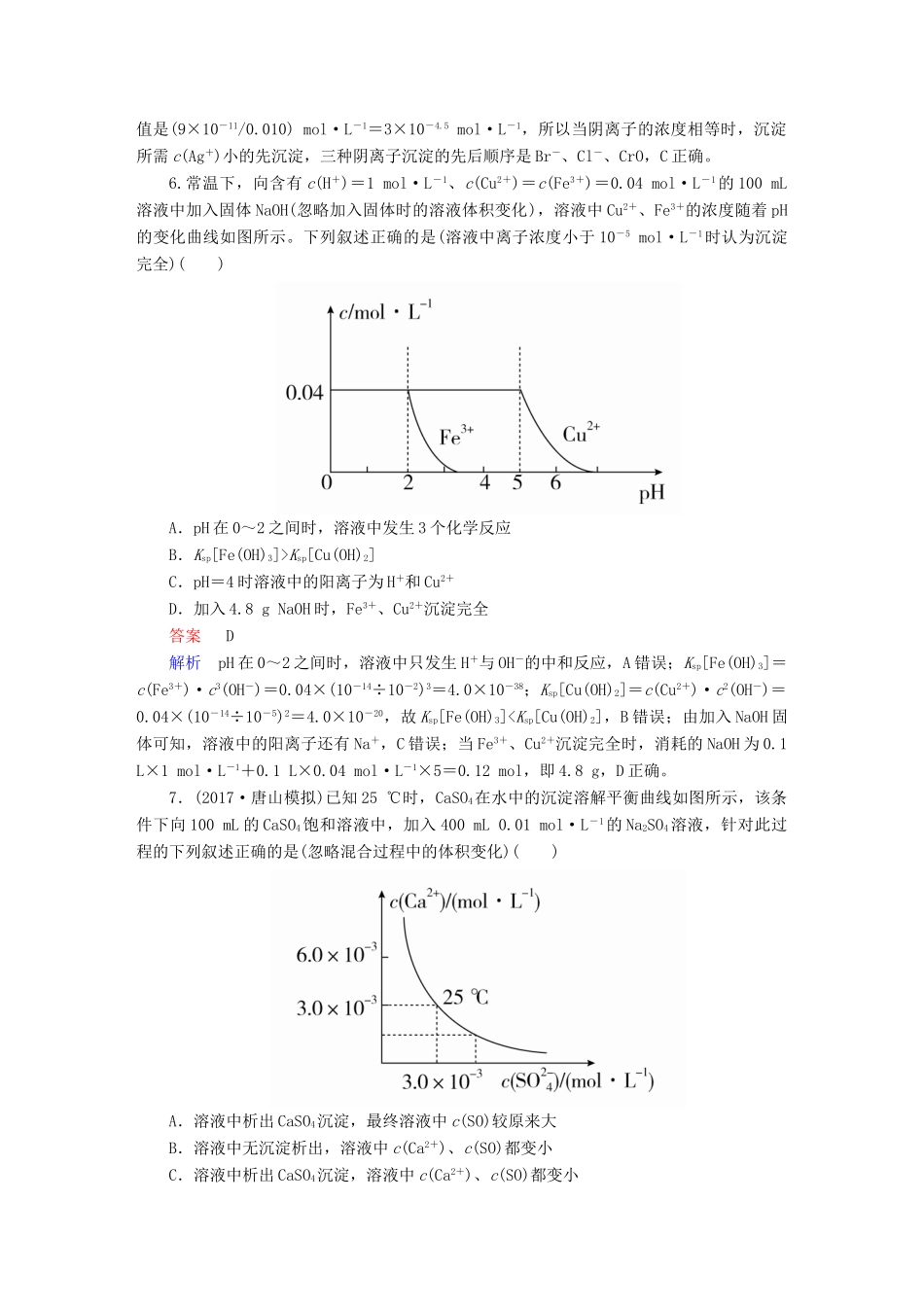
第30讲难溶电解质的溶解平衡(建议用时:40分钟)一、选择题(每题8分,共72分)1.下列说法正确的是()A.难溶电解质的溶度积Ksp越小,则它的溶解度越小B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示C.溶度积常数Ksp与温度有关,温度越高,溶度积越大D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度减小,Ksp也变小答案D解析不同类型的电解质无法由溶度积来比较溶解度大小,同类型的电解质Ksp越小,溶解度才越小,A错误;任何难溶物在水中不一定存在溶解平衡,只有难溶电解质在水中存在溶解平衡,溶解度大小才可以用Ksp表示,B错误;溶度积常数Ksp与温度有关,温度升高,溶度积常数可能增大也可能减小,C错误;升高温度,沉淀溶解平衡逆向移动,则说明它的溶解度减小,所以Ksp也变小,D正确。2.某温度下,难溶物FeR的水溶液中存在平衡:FeR(s)Fe2+(aq)+R2-(aq),其沉淀溶解平衡曲线如图所示。下列说法正确的是()A.可以通过升温实现由a点变到c点B.b点对应的Ksp等于a点对应的KspC.d点可能有沉淀生成D.该温度下Ksp=4×10-18答案B解析大多数难溶电解质的溶解平衡一般是吸热反应,若升高温度能促进该物质溶解,则c(Fe2+)和c(R2-)均增大,不能由a点变到c点,A错误;温度不变,Ksp不变,B正确;溶解平衡曲线右上方表示过饱和溶液,有沉淀生成,曲线左下方表示不饱和溶液,所以d点没有沉淀生成,C错误;该温度下Ksp=2×10-18,D错误。3.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是()A.将饱和Na2SO4溶液加入饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关C.已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=4.0×104D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-5mol·L-1答案A解析将饱和Na2SO4溶液加入饱和石灰水中,有白色沉淀产生,说明硫酸钙的溶解度小,但溶度积表达式类型不同,不能判断其相对大小,A错误;Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关,B正确;Ksp[Fe(OH)3]=c3(OH-)·c(Fe3+),反应的平衡常数K=c(Fe3+)/c3(H+)=[c3(OH-)·c(Fe3+)]/K=4.0×104,C正确;测得混合液的pH=11,Ksp[Mg(OH)2]=c2(OH-)·c(Mg2+),c(OH-)=10-3mol·L-1,代入求得c(Mg2+)=1.8×10-5mol·L-1,D正确。4.25℃时,5种银盐的溶度积常数(Ksp)分别是:AgClAg2SO4Ag2SAgBrAgI1.8×10-101.4×10-56.3×10-507.7×10-138.51×10-16下列说法正确的是()A.氯化银、溴化银和碘化银的溶解度依次增大B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度D.将浅黄色溴化银固体浸泡在5mol·L-1氯化钠溶液中,会有少量白色固体生成答案D解析AgCl、AgBr、AgI的Ksp依次减小,因此溶解度依次减小,A错误;Ksp(Ag2SO4)远大于Ksp(Ag2S),因此Ag2SO4溶解于水后向其中加入少量Na2S溶液,Ag2SO4可转化为Ag2S,产生黑色沉淀,B错误;食盐水相对于水,c(Cl-)增大,AgCl在食盐水中溶解平衡逆向移动,则在食盐水中溶解度小,C错误;氯化钠溶液中,氯离子的浓度较大,溴化银固体浸泡在其中,会使氯离子与银离子的浓度积大于其溶度积,所以会有少量白色固体生成,D正确。5.(2017·桂林模拟)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()A.Cl-、Br-、CrOB.CrO、Br-、Cl-C.Br-、Cl-、CrOD.Br-、CrO、Cl-答案C解析根据溶度积的定义,Cl-、Br-和CrO的浓度均为0.010mol·L-1,Cl-沉淀时c(Ag+)的最小值是1.56×10-10/0.010mol·L-1=1.56×10-8mol·L-1,Br-沉淀时c(Ag+)的最小值是7.7×10-13/0.010mol·L-1=7.7×10-11mol·L-1,Cr...