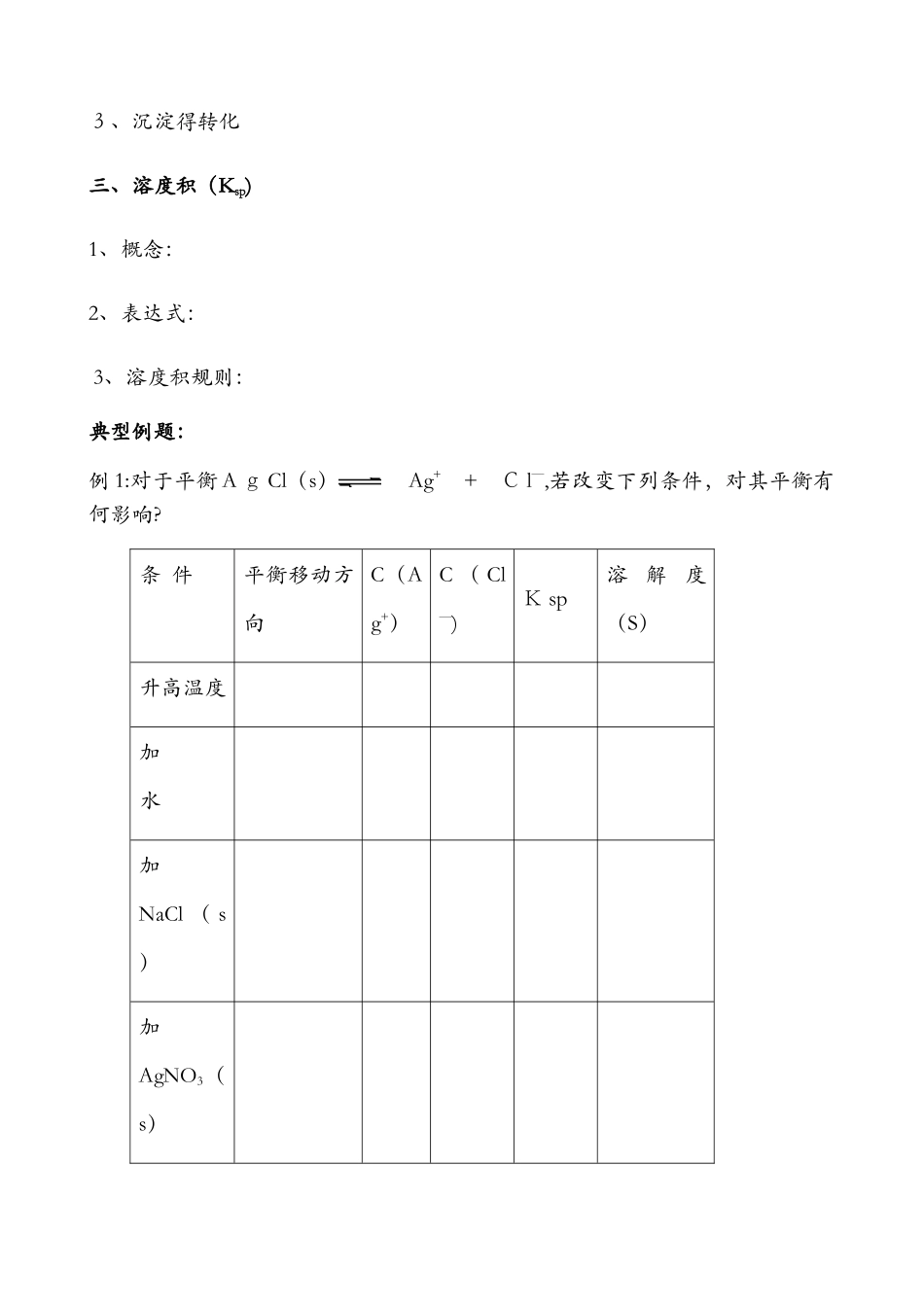
高中化学总复习一轮复习 难溶电解质得溶解平衡考纲解读:1、掌握难溶电解质得溶解平衡及溶解平衡得应用2、运用平衡移动原理分析、解决沉淀得溶解和沉淀得转化问题知识精讲一、溶解平衡1、难溶电解质得定义是什么?难溶物得溶解度是否为 0?在 20℃时电解质得溶解性与溶解度得关系如下:溶解性易溶可溶微溶难溶溶解度2、当 AgNO3与N aCl 反应生成难溶A g C l 时,溶液中是否含有 Ag+和 Cl—?此溶液是否为 AgCl 得饱和溶液?ﻫ3、难溶电解质(如 AgCl)是否存在溶解平衡?并写出 AgC l得溶解平衡表达式。4、溶解平衡得概念?其有哪些特征?二、沉淀反应得应用1、沉淀得生成2、沉淀得溶解3、沉淀得转化三、溶度积(Ksp)1、概念:2、表达式:3、溶度积规则:典型例题:例 1:对于平衡 A g Cl(s) Ag+ + C l—,若改变下列条件,对其平衡有何影响?条 件平衡移动方向C(Ag+)C ( Cl—)K sp溶解度(S)升高温度加 水加NaCl ( s)加AgNO3(s)例 2:已知 Ag2SO4得KP 为 2、0×10—3,将适量 A g 2S O4固体溶于 10 0 m L水中至刚好饱和,该过程中 Ag+和 S O42-浓度随时间变化关系如右图(饱和 Ag2SO 4溶液中 c(A g+)=0、0 34 m ol·L—1)。若 t 1时刻在上述体系中加入 100 m L、 0、02 0 mol·L—1 Na2SO4 溶液,下列示意图中,能正确表示t 1时刻后A g+和 SO42—浓度随时间变化关系得是( )例 3 已知:25℃时,K sp[M g(OH)2]=5、61×10-12,Ksp[M g F 2]=7、42×1 0-11。下列说法正确得是( )A、25℃时,饱和M g(OH)2溶液与饱和 MgF 2溶液相比,前者得 c(M g 2+)大B、2 5℃时,在 Mg(O H)2得悬浊液中加入少量得 N H 4Cl 固体,c(Mg2+)增大C、25℃时,Mg(O H)2固体在 20 mL 0、01 mol/L 氨水中得 Ksp比在20 mL 0、0 1 m o l/LNH4Cl 溶液中得 Ksp小D、2 5℃时,在 Mg(O H)2悬浊液中加入N aF 溶液后,M g(OH)2不可能转化为 MgF2例4:硫酸锶(SrSO 4)在水中得沉淀溶解平衡曲线如下,下列说法正确得是A、温度一定时,Ksp(SrS O 4)随得增大而减小B、三个不同温度中,31 3K 时 Ks p(Sr S O 4)最大C、2 8 3K 时,图中 a 点对应得溶液是不饱和溶液D、2 8 3K 下得S rSO4饱和溶液升温到 263K 后变为不饱和溶液例 5:下列叙述正确得是...