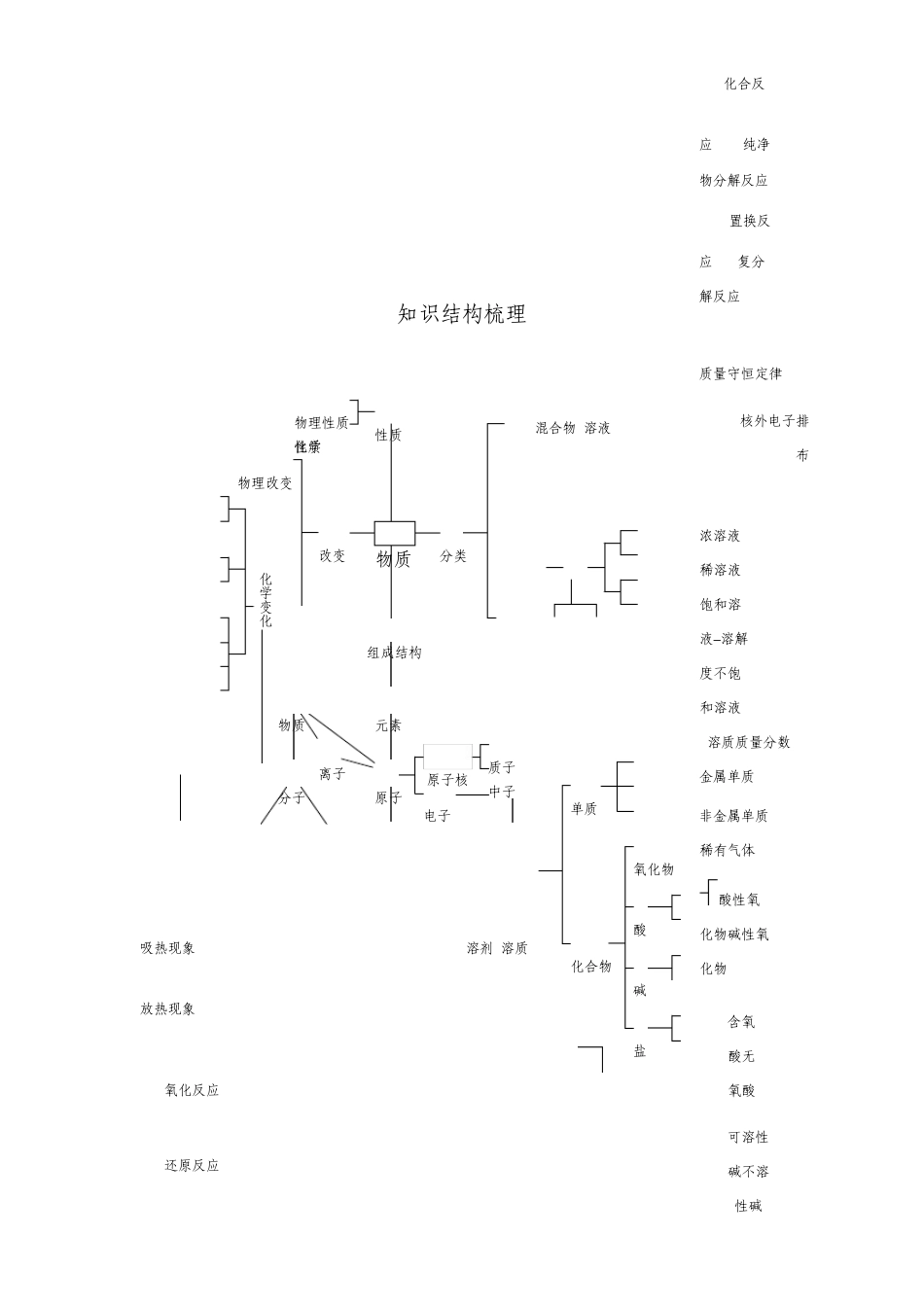
专题 1 基本概念和基本原理 知识结构梳理 混合物 溶液 吸热现象 溶剂 溶质 放热现象 氧化反应 还原反应 化合反应 纯净物分解反应 置换反应 复分解反应 质量守恒定律 核外电子排布 浓溶液稀溶液饱和溶液 溶解度不饱和溶液 溶质质量分数金属单质 非金属单质稀有气体酸性氧化物碱性氧化物 含氧酸无氧酸 可溶性碱不溶性碱 物质 分类 改变 元素 原子 分子 离子 物质 物理改变 化学变化 组成结构 电子 中子 原子核 性质 物理性质 化学性质 质子 氧化物 酸 碱 盐 化合物 单质 含氧酸盐无氧酸盐 化学方程式 化学式 化合价 元素符号 原子结构简图 离子结构简图 离子符号 1、 物质组成结构 (1)物质微观组成 组成物质三种基本微粒:分子,原子,离子。 (2)分子、原子、离子区分与联络 分 子 原 子 离 子 保持物质 化学性质 性质 是化学改变中 最小 概 念 带电 原子 或 原子团 最小 微粒 微粒 在化学改变中单原子离子通常化学变 在化学改变中 能够再分 在化学改变中 不能再分 不可分,但原子团组成离子化中是 分,改变前后种类和数目 分,改变前后种类和数目不可能分割成其它离子、原子或区 否可分 可能发生改变。 发生改变。 分子。 能独立存在,组成物质并 有些能独立存在,并直接构 是否独 保持物质化学性质不成物质,且能保持物质化 阴阳离子共同组成物质。 立存在 变。 学性质不变。 由原子得失电子形成,原子得别 同种原子或不一样种原子通通常有 质子 、 中子 和核 电子带 负电 电荷成为 阴离构 成 过共用电子对形成。且纯外电子三种微粒组成。 子 离子,原子失去电子带 正净物中仅含有一个分子。 电 电荷,成为 阳离子 离子。所显电 阴离子:带 负 电荷 不显 电性 不显 电性 性情况 阳离子:带 正 电荷 表 示 用 化学式 (分子式)表 用 元素符号 或原子结构 分别以阴、阳离子符号或离子方 法 示 示意图表示。 结构示意图表示。 在化学 在化学反应中原分子破裂 在化学反应中得失电子 反应中 分子 原子 离子 表现 在化学反应中重新组合成新分子 在化学反应中得失电子 表 达 均为微观粒子,既可讲个数,又可论种类。 方 法 基 本 体积 小 ,质量 小 ,都是在不停 运动 ,微粒之间有 间隙 。同种微粒 性质 相 属 性 同,不一样种微粒性质不一样。 (3)原子结构 ...