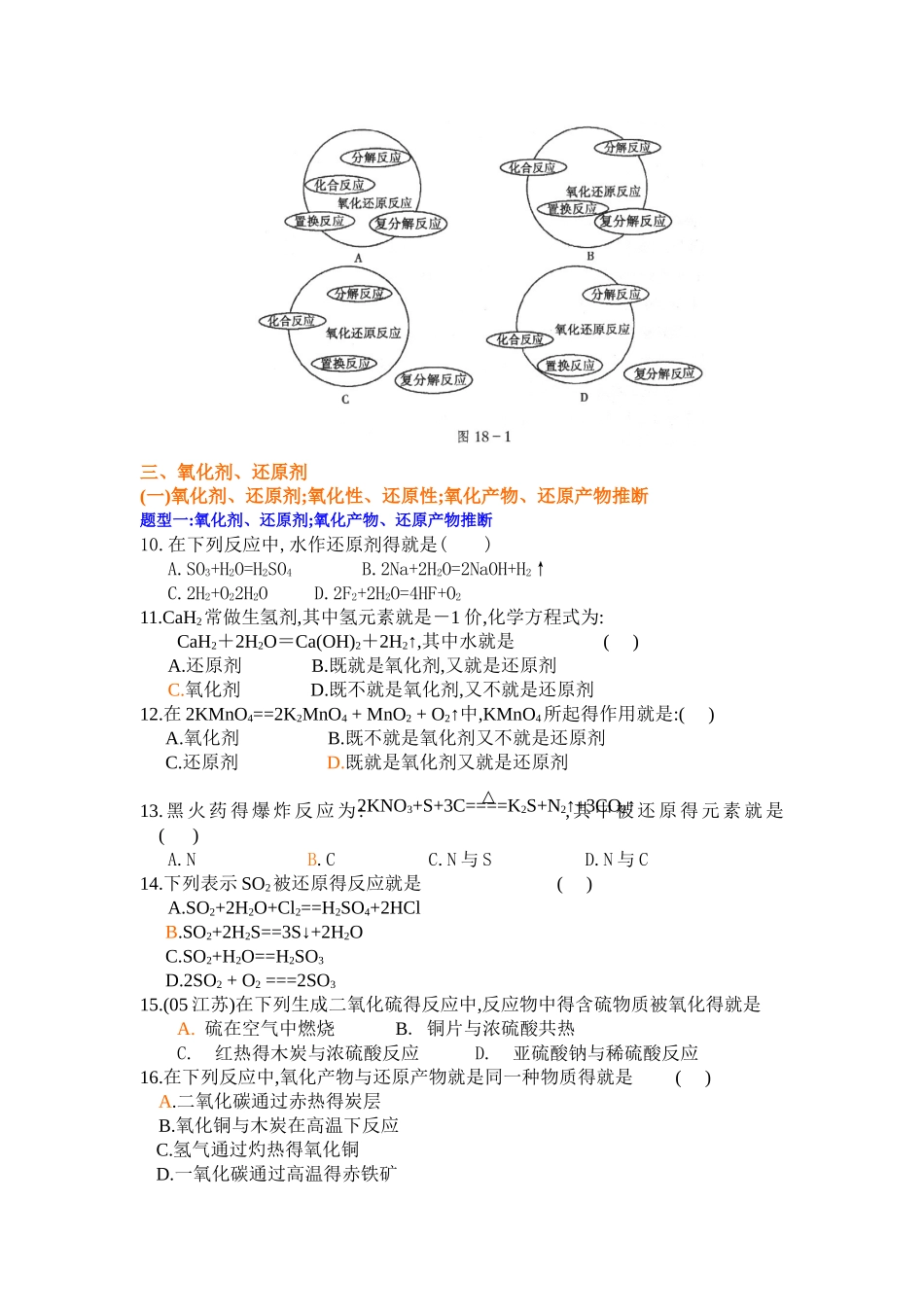
氧化还原反应知识点复习与练习1、氧化还原反应定义:有化合价变化得反应就叫做氧化还原反应。(推断得依据)本质:有电子转移 ( 得失或偏移 ) 2、氧化反应:化合价升高,失去电子得反应叫氧化反应。还原反应:化合价降低,得到电子得反应叫还原反应。3、氧化还原反应实质得表示方法(1)电子得失法即双线桥法a、两条线桥从反应物指向生成物,且对准同种元素b、要标明"得"、"失"电子,且数目要相等。c、箭头不代表电子转移得方向。(2)电子转移法即单线桥法a、一条线桥表示不同元素原子得失电子得情况。b、不需标明"得"、"失"电子,只标明电子转移得数目。c、箭头表示电子转移得方向。d、单线桥箭头从还原剂指向氧化剂。4、氧化剂、还原剂性质化合价得失电子发生得反应对应产物氧化剂氧化性降低得电子还原反应还原产物还原剂还原性升高失电子氧化反应氧化产物常见还原剂常见氧化剂(1) 活 泼 金 属 单 质 , 如K、Na、Mg、Al 等(1) 活 泼 非 金 属 单 质 ,如:F2、Cl2、Br2、I2、O2、O3等(2)非金属离子,(3)含低价态元素得化合物(4)某些非金属单质如S2- 、 H2S 、 SO 、 I-、HI、HCl、NH3、CO、H2、Si、C、Fe2+、Cu+、(2)含 较 高 价 态 元 素 得 化 合 物如:HNO3、H2SO4、KClO3、KMnO4、MnO2、HClO、NO2等(3) Fe3+某些物质既可作氧化剂又可作还原剂,如:Na2O2、H2O25、氧化还原反应与四种基本反应类型得关系 (1) 置换反应都就是氧化还原反应。(2)化合反应不都就是氧化还原反应,有单质参加得化合反应就是氧化还原反应。(3)分解反应不都就是氧化还原反就,有单质生成得分解反应才就是氧化还原反应。(4) 复分解反应都不就是氧化还原反应。6、氧化性还原性强弱得推断(1)氧化性:氧化剂>氧化产物(2)还原性:还原剂>还原产物(3)金属单质得还原性瞧金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au失电子能力逐渐减弱,还原性逐渐减弱单质还原性强,其对应得离子得氧化性就弱。金属离子得氧化性瞧金属活动顺序表倒过来得顺序。例如下列几种阳离子氧化性由强到弱得顺序就是:Ag+>Cu2+>Fe2+>Al3+>K+(注:Fe3+>Cu2+)8、氧化还原方程式得配平一般用"化合价升降法"或"电子得失法"配平。配平原则就是"化合价升降总数相等"或"得失电子总数相等"。下面以硫与浓硝酸反应为例,说明配平得一般步骤:(1)标变价:标出氧化剂、还原剂、氧化产物、还原产物中价变元素得化合价。(2)求总数:求得失电子数得最小公...