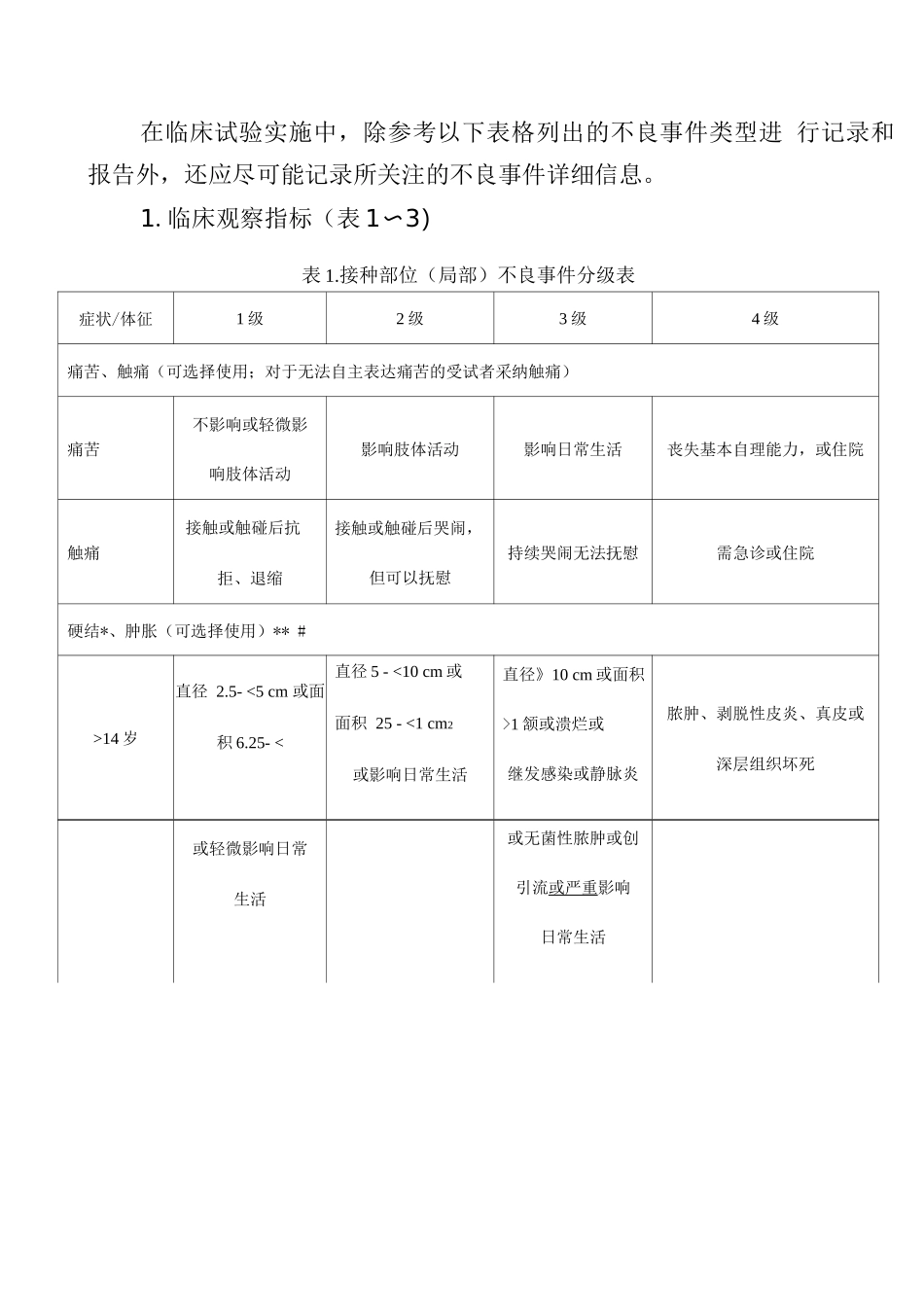
附件 1预防用疫苗临床试验不良事件分级标准指导原则一、前言预防用疫苗(以下简称疫苗)是指为预防、控制疾病的发生、 流行,用于人体免疫接种的预防性生物制品,包括免疫规划疫苗 和非免疫规划疫苗。疫苗临床试验应严格遵守《中华人民共和国药品管理法》《中 华人民共和国疫苗管理法》,执行《药品注册管理办法》的相关规 定,根据《药物临床试验质量管理法律规范》(GCP)、《疫苗临床试验 技术指导原则》和《疫苗临床试验质量管理指导原则(试行)》 等相关要求进行。由于疫苗通常用于健康人群,多数为健康儿童 或婴幼儿,一般情况下其各阶段临床试验选择健康受试者,因此 在疫苗的临床试验中,对安全性方面的考虑和风险控制的要求应 高于治疗性药物,实行最严格的管理制度,坚持风险管理和全程 管控。本指导原则为针对疫苗临床试验制定的不良事件分级标准, 旨在通过对不良事件与接种疫苗因果关系的合理分析和判定,科 学地监测和评估疫苗相关不良反应,最大程度地降低健康受试者 在临床试验中的风险以及疫苗使用者的风险。本指导原则基于现行法规和行业标准体系以及当前认知水 平起草,所采纳的分级标准和依据,参考了境外监管机构发布的 同类指导原则和行业指南,并结合了我国的临床实践经验而制 定,将随着相关法规和标准的不断完善以及科学知识水平的提高 适时更新。二、适用范围本指导原则适用于对疫苗临床试验中发生的不良事件严重 程度(即强度)进行分级评估。由于疫苗临床试验的受试者可能 为成人、青少年、儿童或婴幼儿,因此应依据不同年龄段人群生 理特点对试验中的临床症状、体征及实验室检测指标异常的严重 程度进行评估。分级评估标准也可作为疫苗临床试验设计中规定 的紧急揭盲标准,以及是否暂停/终止临床的参考。同时,本指 导原则提供的统一不良事件分级标准也有助于同一临床试验或 不同临床试验间安全性数据的比较。三、基本内容本指导原则提供的疫苗临床试验不良事件的分级指标包括 两部分:第一部分为临床观察指标(即症状和体征,包括接种部 位不良事件、生命体征、非接种部位不良事件);第二部分为实 验室检测指标(血液生化、血液常规、尿液常规等)。在进行临 床试验时,可根据疫苗特性、受试者人群特征和疾病危害程度, 从本指导原则的不良事件分级表中选择适宜的观察指标进行安 全性监测与评价。本指导原则并未涵盖疫苗临床试验中所需观察的所有安全 性指标。对于新型疫苗可能需...