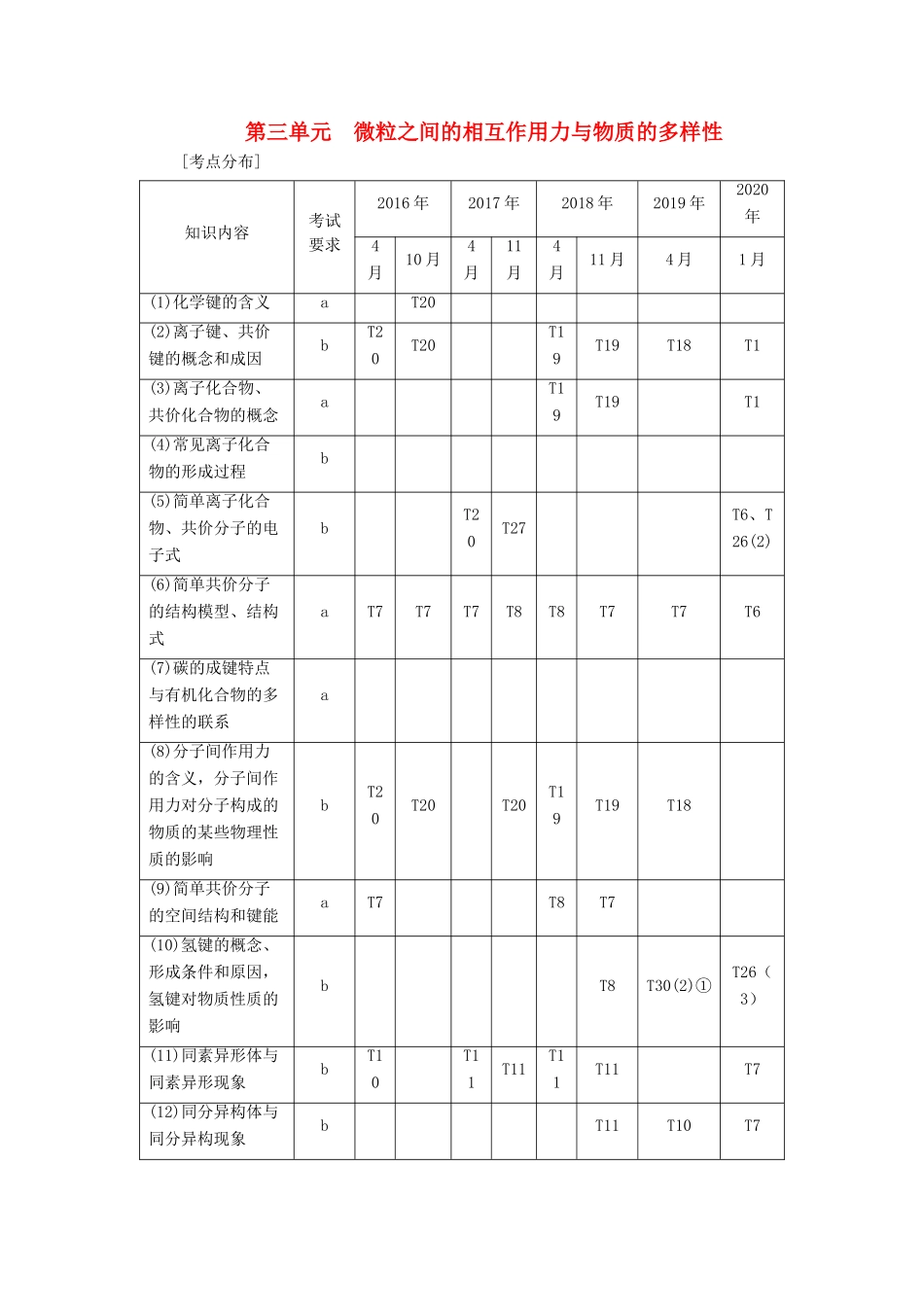
第三单元 微粒之间的相互作用力与物质的多样性 [考点分布]知识内容考试要求2016 年2017 年2018 年2019 年2020年4月10 月4月11月4月11 月4 月1 月(1)化学键的含义aT20(2)离子键、共价键的概念和成因bT20T20T19T19T18T1(3)离子化合物、共价化合物的概念aT19T19T1(4)常见离子化合物的形成过程b(5)简单离子化合物、共价分子的电子式bT20T27T6、T26(2)(6)简单共价分子的结构模型、结构式aT7T7T7T8T8T7T7T6(7)碳的成键特点与有机化合物的多样性的联系a(8)分子间作用力的含义,分子间作用力对分子构成的物质的某些物理性质的影响bT20T20T20T19T19T18(9)简单共价分子的空间结构和键能aT7T8T7(10)氢键的概念、形成条件和原因,氢键对物质性质的影响bT8T30(2)①T26(3)(11)同素异形体与同素异形现象bT10T11T11T11T11T7(12)同分异构体与同分异构现象bT11T10T7(13)NaCl、金刚石、足球烯、干冰、石英中微粒的空间排列方式及相互间作用力aT20T20T20(14)离子晶体、分子晶体、原子晶体、金属晶体的形成方式aT20T19T19(15)离子晶体、分子晶体、原子晶体、金属晶体的主要特性aT20、T22 离子键和共价键1.化学键(1)概念:直接相邻原子或离子间的强烈的相互作用。(2)形成与分类2.离子键(1)概念:使带有相反电荷的阴、阳离子结合的相互作用。(2)成键粒子:阴、阳离子。(3)成键实质:静电作用。(4)形成条件:通常是活泼金属与活泼非金属元素的原子相结合。(5)表示方法① 用电子式表示离子化合物的形成过程Na2S:;CaCl2:。② 常见离子化合物的电子式3.共价键(1)概念:原子间通过共用电子对所形成的强烈的相互作用。(2)成键粒子:原子。(3)成键实质:共用电子对。(4)形成条件:通常是非金属元素的原子相结合。(5)影响因素:键能越大,键长越短越稳定。(6)表示方法① 用电子式表示共价化合物的形成过程② 常见共价分子的电子式③ 写出下列物质的结构式N2:N≡N;H2O:H—O—H;CO2:O===C===O。4.有机物分子中碳原子呈四价,碳原子既可以与其他原子形成共价键,又可以相互成键。碳原子之间可以形成碳碳单键、碳碳双键、碳碳叁键等,有机物可以形成链状分子,也可以形成环状分子,且有机物存在同分异构现象——碳链异构、位置异构、官能团异构构成有机化合物的多样性。题组一常用化学用语的书写与判断1.(2018·浙江 4 月选考,T8)下列表示正确的是( )A.硫原子结构示意图: B.乙炔的结构简式:CHCHC.乙烯的球棍模型:D.NaCl 的电子式:解析:...