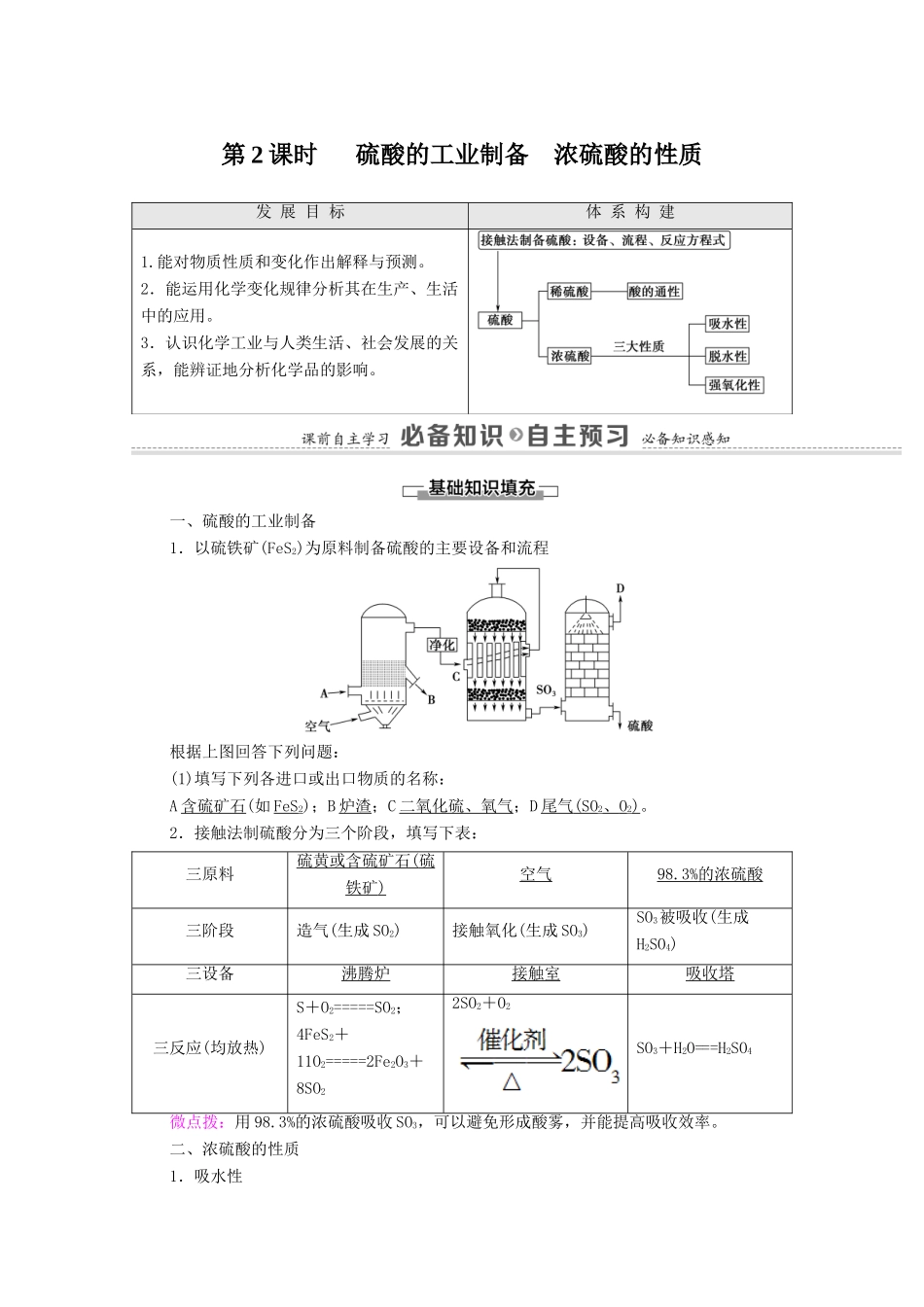
第 2 课时 硫酸的工业制备 浓硫酸的性质发 展 目 标体 系 构 建1.能对物质性质和变化作出解释与预测。2.能运用化学变化规律分析其在生产、生活中的应用。3.认识化学工业与人类生活、社会发展的关系,能辨证地分析化学品的影响。一、硫酸的工业制备1.以硫铁矿(FeS2)为原料制备硫酸的主要设备和流程根据上图回答下列问题:(1)填写下列各进口或出口物质的名称:A 含硫矿石(如 FeS2);B 炉渣;C 二氧化硫、氧气;D 尾气 (SO 2、 O 2)。2.接触法制硫酸分为三个阶段,填写下表:三原料硫黄或含硫矿石 ( 硫 铁矿 ) 空气98.3% 的浓硫酸 三阶段造气(生成 SO2)接触氧化(生成 SO3)SO3被吸收(生成H2SO4)三设备沸腾炉接触室吸收塔三反应(均放热)S+O2=====SO2;4FeS2+11O2=====2Fe2O3+8SO22SO2+O2SO3+H2O===H2SO4微点拨:用 98.3%的浓硫酸吸收 SO3,可以避免形成酸雾,并能提高吸收效率。二、浓硫酸的性质1.吸水性(1)浓硫酸可吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水。(2)常用盛有浓硫酸的洗气瓶干燥某些气体(如 H2、Cl2、SO2等),不能干燥碱性气体(如NH3等)和强还原性气体(如 H2S 等)。2.脱水性(1)浓硫酸能把有机物中的氢、氧元素按水的组成比脱去,剩余黑色的炭。(2)实验探究。现象 1:蔗糖逐渐变黑。原因是浓硫酸具有脱水性:C12H22O11――→12C+11H2O现象 2:蔗糖体积膨胀,形成黑色疏松多孔的海绵状的炭,并放出有刺激性气味的气体 。原因是浓硫酸具有强氧化性,把炭氧化成 CO2,并有 SO2气体放出。微点拨:浓硫酸的脱水作用一般适用于含 C、H 元素的有机物,这些有机物本身没有H2O,但有 H、O 元素,浓硫酸能把有机物中的 H、O 元素按 H2O 的组成比(H∶O=2∶1)脱出来,使这些有机物发生化学变化。3.强氧化性(1)与金属铜的反应实验装置实验现象a 试管中铜丝表面变黑,有气泡逸出;b 试管中的品红溶液逐渐变为无色;c 试管中的紫色石蕊溶液逐渐变为红色;冷却后,将 a 试管里的溶液慢慢倒入水中,溶液变为蓝色。实验结论铜与浓硫酸在加热条件下发生反应,化学方程式为 Cu + 2H 2SO4( 浓 ) ==== = CuSO 4+SO2↑+2H2O。(2)与非金属的反应浓硫酸与木炭反应的化学方程式: C + 2H 2SO4( 浓 ) ===== CO 2↑ + 2SO 2↑ + 2H 2O。 C、Cu 分别与浓硫酸反应时,浓硫酸各表现出什么性质?[提示] 与碳反应时体现浓硫酸的强氧化性...