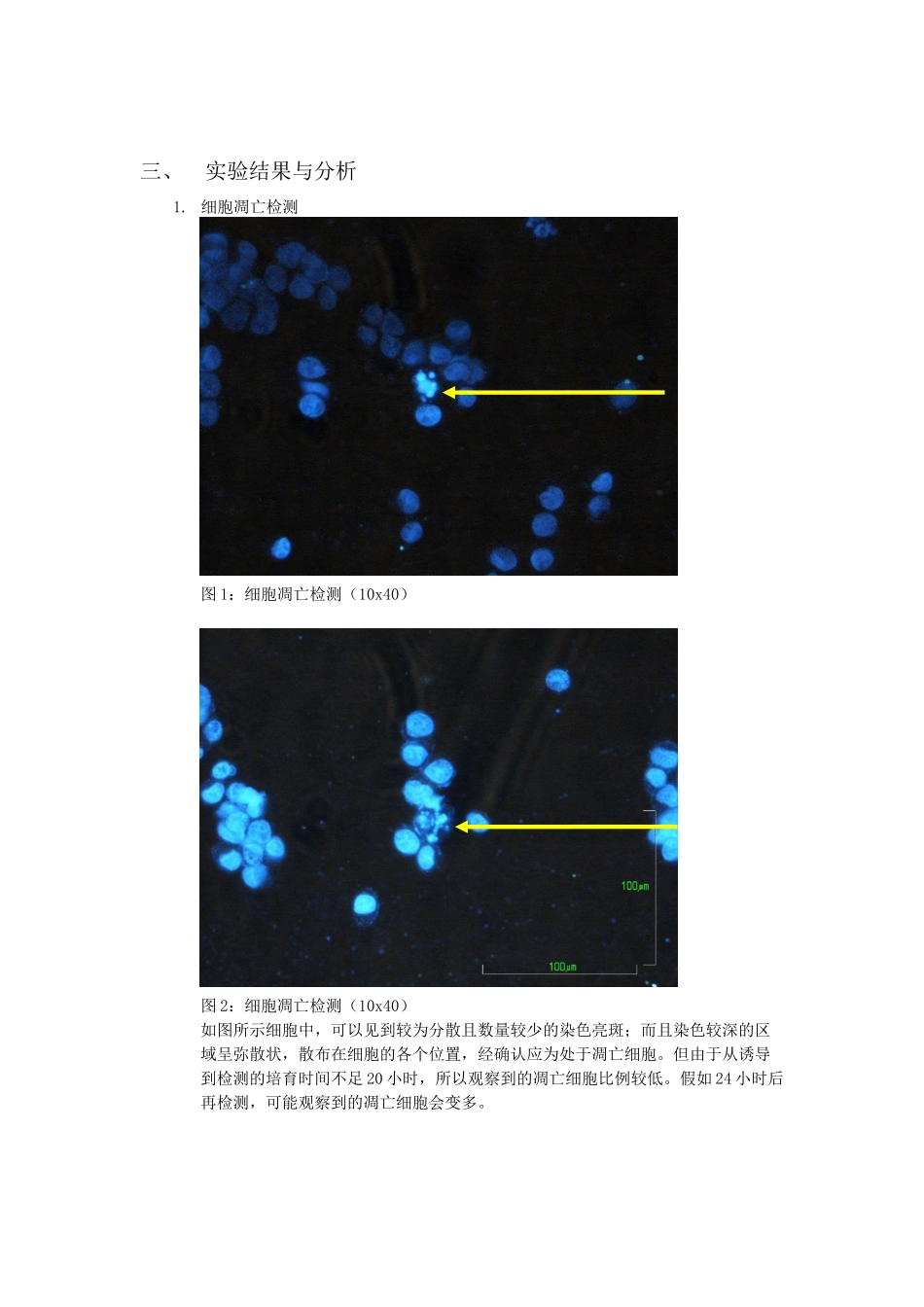
Hela 细胞的凋亡诱导及检测生 05 边晔 2025030026周二班 同组同学:解智博一、实验背景1.细胞凋亡细胞凋亡(apoptosis)或程序化细胞死亡(programmed cell death, PCD),是多细胞有机体为调控机体发育,维护内环境稳定,由基因控制的细胞主动死亡过程,是细胞衰老自然死亡的主要方式之一,并强调这一过程是一种自然的生理学过程。由于细胞凋亡受到严格的由遗传机制决定的程序性调控,所以又被称为程序化细胞死亡。2.DAPI 染色DAPI 即 4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole)﹐为一种荧光染料,可以穿透细胞膜与细胞核中的双链 DNA 结合而发挥标记的作用,可以产生比 DAPI 自身强 20 多倍的荧光。显微镜下可以看到显蓝色荧光的细胞,荧光显微镜观察细胞标记的效率高(几乎为 100 %) ,且对活细胞无毒副作用。 二、实验步骤1. 细胞凋亡诱导1)取 Hela 细胞(35mm 平皿中培育)镜检,观察细胞形状、数目、密度、污染状况等。2)吸弃皿中的培育基,再加入 1ml PBS 溶液洗去残余培育基,弃掉培育皿中液体。3)加入 1.5ml 新奇的完全培育基,加入 150l H2O2,至终浓度为 0.8mmol/L。4)标记,放入 1 号培育箱中培育。第二天检测细胞凋亡情况。2. 细胞凋亡检测1)取前一天加过氧化氢培育的 hela 细胞,加入 200l 胰酶消化 3 分钟,再加入适量 PBS 溶液并反复吹吸至细胞分散,转移到 1.5mL EP 管中,1000rpm 离心 5 分钟2)吸出上清,于沉淀中加入 100l 甲醇,冰箱中固定 10 分钟3)1000rpm 离心 5 分钟4)弃上清,加 100l PBS 洗涤沉淀细胞5)1000rpm 离心 5 分钟6)弃上清,加 50lPBS 溶液,0.5l DAPI 染液,室温染色 10 分钟7)1000rpm 离心 5 分钟8)弃上清,加 100l PBS 洗涤9)1000rpm 离心 5 分钟10) 弃上清,加 15l PBS 重悬细胞11) 取 15l 悬液于玻片上并于正置荧光显微镜下观察并拍照三、实验结果与分析1. 细胞凋亡检测 图 1:细胞凋亡检测(10x40)图 2:细胞凋亡检测(10x40)如图所示细胞中,可以见到较为分散且数量较少的染色亮斑;而且染色较深的区域呈弥散状,散布在细胞的各个位置,经确认应为处于凋亡细胞。但由于从诱导到检测的培育时间不足 20 小时,所以观察到的凋亡细胞比例较低。假如 24 小时后再检测,可能观察到的凋亡细胞会变多。四、讨论1. 凋亡检测注意事项1)为使得细胞充分接触固定液,应轻柔用移液器混合...