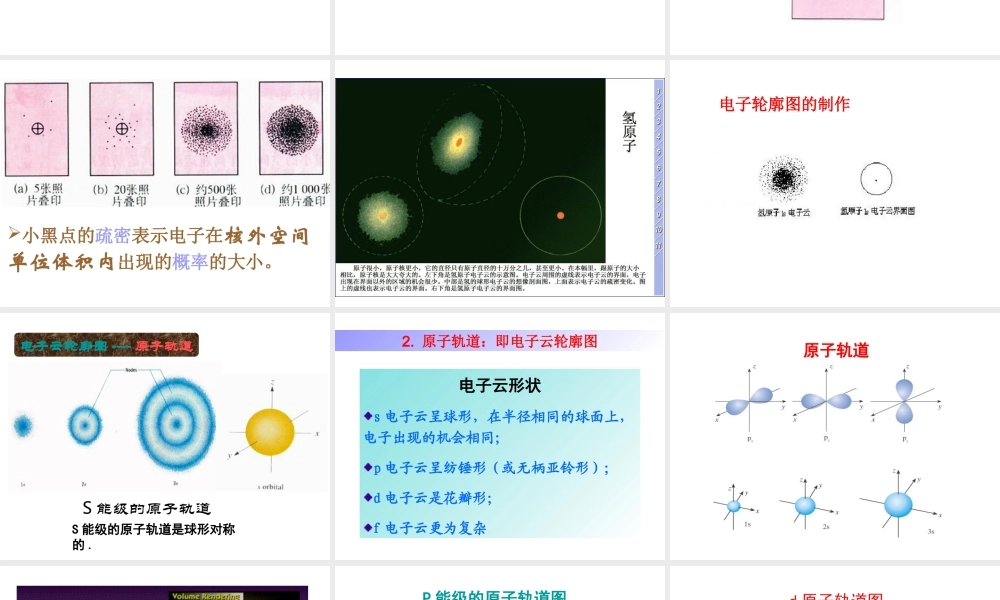
第一节 原子结构(第 3 课时)复习 构造原理1 s2 s3s4s5s6s7 s2p3p3d4p4d4f5p5d5f6p6d7p1~36 号元素中是否都遵循构造原理? 举出能否具体的例子?24 号铬: 1s22s22p63s23p64s13d529 号铜 : 1s22s22p63s23p64s13d10五、电子云与原子轨道思考 宏观物体的运动特征:宏观物体的运动特征:可以准确地测出它们在某一时刻所处的 可以准确地测出它们在某一时刻所处的 位置及运行的速度; 位置及运行的速度;可以描画它们的运动轨迹。可以描画它们的运动轨迹。1. 电子云微观物体的运动特征:电子的质量很小,只有 9.11×10-31千克;核外电子的运动范围很小(相对于宏观物体而言);电子的运动速度很大;测不准小黑点的疏密表示电子在核外空间单位体积内出现的概率的大小。电子轮廓图的制作S 能级的原子轨道电子云轮廓图 ---- 原子轨道S 能级的原子轨道是球形对称的 .2. 原子轨道:即电子云轮廓图电子云形状s 电子云呈球形,在半径相同的球面上,电子出现的机会相同;p 电子云呈纺锤形 ( 或无柄亚铃形 ) ;d 电子云是花瓣形;f 电子云更为复杂原子轨道P 能级的原子轨道图d 原子轨道图观察图 1-14 ,这些图称为原子的电子轨道表示式1 .每个原子轨道最多只能容纳几个电子?2 .当电子排在同一个能级内时,有什么规律?科学探究科学探究★ 核外电子排布规则1. 能量最低原理 2. 泡利不相容原理 举例说明泡利原理:举例说明洪特规则:当电子排布在同一能级的不同轨道时,总是首先单独占一个轨道(即分占不同的轨道),而且自旋方向相同。(全空、半充满、全充满)一个原子轨道最多容纳 2 个电子,而且自旋方向相反。3. 洪特规则 4. 补充规则相对稳定的状态全充满( p6 , d10 ,f14 )全空时( p0 , d0 ,f0 )半充满( p3 , d5 , f7 )能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”注意:注意↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↓↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑↑↑↑↑↑↑↑↑↑↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑↑↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↓其中最能准确表示基态锰原子核外电子运动状态的是( )ABCDC↑↑↑↓↑↓↑↑↑↑↑↓当碳原子的核外电子排布由转变为时,下列说法正确的是 ( )A. 碳原子由基态变为激发态 B. 碳原子由激发态变为基态C . 碳原子要从外界环境中吸收能量D. 碳原子要向外界环境释放能量A C