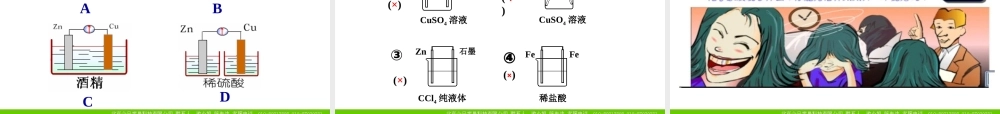
原电池的工作原理⑴ 将 Zn 片插入 H2SO4溶液中有什么现象?为什么?⑵ 将 Cu 片插入 H2SO4 溶液中有什么现象?为什么?演示探究⑷ 若将 Zn 片 ,Cu 片用一导线连接再浸在 H2SO4 溶液中,有什么现象?为什么?⑶ 将一 Zn 片 ,Cu 片平行插入 H2SO4 溶液中,有什么现象?为什么?⑸ 导线间接一电流计有何现象产生?为什么?⑹ 用一干电池连接电流计验证电子流向,确定 Zn 片 , Cu 片的正负极是怎样的?实验现象实验结论实验 1实验2实验3实验4铜片上没有明显现象,锌片上有无色气体产生。铜片上没有明显现象,锌片上有无色气体产生。铜片上有无色气体产生,锌片无明显现象。铜片上有无色气体产生,锌片无明显现象,电流计发生偏转。H+ 在铜片上得到电子被还原成氢气。H+ 在铜片上得到电子被还原成氢气,说明有电子从锌片流入到铜片 .铜片与稀硫酸不反应,2H++Zn=Zn2++H2铜片与稀硫酸不反应,2H++Zn=Zn2++H2原电池 问题探究 1 、你能找到原电池的正负极吗 ?这一原电池在工作时的电流流动方向是怎样的?定义 : 把化学能转变为电能的装置。 电子由锌片经导线流向铜片,电流由铜片流出,从锌片流入。、锌片: Zn - 2e -= Zn2+ (氧化反应)铜片: 2H++2e -= H2↑ (还原反应) 问题探究 2. 你知道原电池的工作原理吗?能不能写出在二个电极上的离子反应方程式?原电池的工作原理:氧化还原反应电极材料电极反应反应类型原电池的电极Zn 片Cu 片电池总反应氧化反应Zn - 2e- = Zn2+2H+ + 2e- =H2↑负极正极Zn+2H+ = Zn2++H2↑锌铜原电池原理还原反应意大利物理学家亚历山德罗 . 伏打(Alessandro Volta)伏打电池1. 原电池:将化学能转化成电能的装置装置化学能转化为电能原电池的原理:氧化还原反应总反应:2H++2e-=H2↑Zn - 2e-=Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑( 离子方程式)(化学方程式)正极:负极:(氧化反应)(还原反应)2. 电极反应负极正极Zn-2e-=Zn2+2H+ +2e-=H2还原剂 (Zn) 失去电子,发生氧化反应氧化剂 (H+) 在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极 .经外电路Zn2+H+SO42-电流方向装置中电流方向、正负电极、电子流动方向、电极上的反应情况分析 思考 : 化学能是如何转变成电能的呢?思考 : 构成原电池的条件有哪些呢?实验探究形成原电池的条件形成条件一:活泼性不同的两个电极负极:较活泼的金属正极:较...