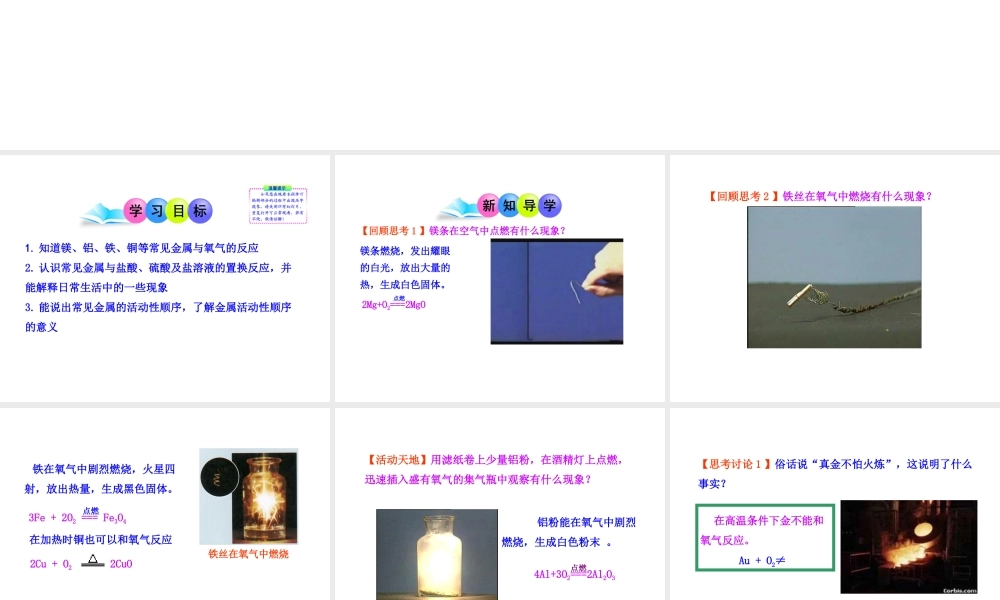
课题 2 金属的化学性质1. 知道镁、铝、铁、铜等常见金属与氧气的反应2. 认识常见金属与盐酸、硫酸及盐溶液的置换反应,并能解释日常生活中的一些现象3. 能说出常见金属的活动性顺序,了解金属活动性顺序的意义【回顾思考 1 】镁条在空气中点燃有什么现象?镁条燃烧,发出耀眼的白光,放出大量的热,生成白色固体。2Mg+O2===2MgO 点燃【回顾思考 2 】铁丝在氧气中燃烧有什么现象?铁丝在氧气中燃烧3Fe + 2O2 === Fe3O4 点燃2Cu + O2 2CuO 铁在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体。在加热时铜也可以和氧气反应【活动天地】用滤纸卷上少量铝粉,在酒精灯上点燃,迅速插入盛有氧气的集气瓶中观察有什么现象? 铝粉能在氧气中剧烈燃烧,生成白色粉末 。4Al+3O2===2Al2O3点燃【思考讨论 1 】俗话说“真金不怕火炼”,这说明了什么事实? 在高温条件下金不能和氧气反应。Au + O2≠ 高 温 炼 金( 1 ) 4Al+3O2=2Al2O3 ( 2 ) 2Cu+O2 2CuO( 3 ) 2Mg+O2 == 2MgO ( 4 ) Au + O2 → 不反应 ( 5 ) 3Fe+2O2 == Fe3O4 点燃【思考讨论 2 】从以下方程式你能得到哪些信息?点燃 实验表明,大多数金属都能与氧气发生反应,生成相应的金属氧化物,但反应的难易程度和剧烈程度是不相同的。 一、金属与氧气的反应1 .常温下易与氧气反应: 以 、 为代表。2 .加热时能与氧气反应:以 、 为代表。3 .高温下也不能与氧气反应:以 为代表。 MgAlFeCuAu【结论】金属活动性: Mg 、 Al > Fe 、 Cu >Au【活动与探究 1 】探究镁、锌、铁、铜的活动性顺序 A 组:把镁、锌、铁、铜分别放入稀盐酸中。B 组:把镁、锌、铁、铜分别放入稀硫酸中。二、金属与酸的反应金属活动性顺序 很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。 金属与酸的反应现象注意:视频中没有镁与酸反应的现象金属稀盐酸现象反应的化学方程式镁 锌 铁 铜放出气泡最迅速,反应最剧烈。放出气泡速度次之,反应较为剧烈。放出气泡速度最慢,反应较为缓和,溶液由无色变为浅绿色。不反应Mg + 2HCl ==== MgCl2 + H2↑Zn + 2HCl ==== ZnCl2 + H2↑Fe + 2HCl ==== FeCl2 + H2↑金属稀硫酸现象反应的化学方程式镁 锌 铁 铜放出气泡最迅速,反应最剧烈。放出气泡速度次之,反应较为剧...