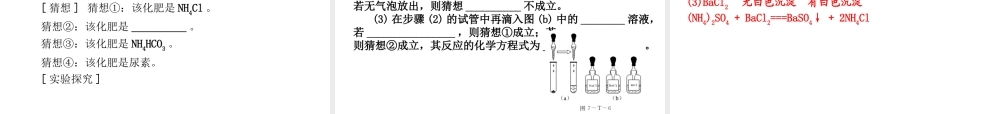
整合拓展创新整合拓展创新单元知识框架单元知识框架单元知识框架一、常见的酸第六章 溶解现象酸盐酸 (HCl)硫酸 (H2SO4)备注及用途物理性质 无色液体,易挥发,有刺激性气味,在空气中形成白雾 ( 盐酸越浓,越易挥发 ) 无色液体,无挥发性,无气味 浓度越大,其密度就越大化学性质跟指示剂的反应 (pH<7 ,溶液呈酸性 ) 使紫色石蕊试液变红,不能使无色酚酞试液变色利用此性质可以鉴别某物质是否呈酸性跟金属反应HCl + Zn===ZnCl2 + H2↑H2SO4 + Zn===ZnSO4+ H2↑利用此性质可以:①制盐和氢气;② 判断金属的活动性2HCl + Mg===MgCl2 + H2↑H2SO4 +Mg===MgSO4 + H2↑HCl + Fe===FeCl2 + H2↑ 浅绿H2SO4 + Fe===FeSO4+ H2↑酸+活泼金属―→盐+氢气第六章 溶解现象跟金属氧化物的反应Fe2O3 + 6HCl===2FeCl3 + 3H2OFe2O3 +3H2SO4===Fe2(SO4)3 +3H2O 可用于:①制盐;②金属表面除锈2HCl + CuO===CuCl2 + H2OH2SO4 + CuO===CuSO4 +H2O酸+金属氧化物―→盐+水跟碱反应HCl + NaOH===NaCl + H2OH2SO4 + 2NaOH===Na2SO4+ 2H2O 利用此性质可以:① 制盐; ②中和胃酸——用Al(OH)3 ;③除去水垢中的 Mg(OH)22HCl + Cu(OH)2===CuCl2 + 2H2OH2SO4 +Cu(OH)2===CuSO4 + 2H2O酸+碱―→盐+水第六章 溶解现象跟某些盐的反应2HCl + Na2CO3===2NaCl +H2O + CO2↑H2SO4 +Na2CO3===Na2SO4 +H2O + CO2↑利用此性质可以:①区别盐酸和硫酸——用 BaCl2溶液;②用盐酸制 CO2 气体; ③制盐;④除去水垢中的 CaCO32HCl + CaCO3===CaCl2 + H2O +CO2↑H2SO4 +CaCO3===CaSO4 + H2O+ CO2↑HCl + AgNO3===AgCl↓ + HNO3H2SO4 +BaCl2===BaSO4↓ +2HCl 酸+盐―→新盐+新酸第六章 溶解现象酸的共性 ( 原因是酸溶液中的阳离子全是 H + ) :二、常见的碱第六章 溶解现象碱氢氧化钠 (NaOH)氢氧化钙 [Ca(OH)2]备注及用途俗名 苛性钠、火碱、烧碱 熟石灰或消石灰 -------------------------物理性质 白色固体,易潮解( 常用作干燥剂 ) ,易溶于水,溶解时放热 白色粉末状固体,微溶于水,它的水溶液俗称石灰水 NaOH 可用作干燥剂。注意不能干燥酸性气体( CO2 、 SO2 、 HCl等 )第六章 溶解现象碱氢氧化钠 (NaOH)氢氧化钙[Ca(OH)2]备注及用途化学性质与指示剂反应(pH > 7, 溶液呈碱性 ) ...