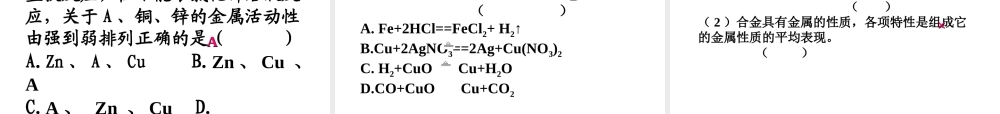第六章 第二节 【教学目标】1. 理解掌握金属的化学性质。2. 初步认识置换反应,能用置换反应解释一些有关的化学问题。3. 知道金属活动性顺序,并能解释与日常生活相关的一些现象。【教学重点】金属的化学性质,金属活动性顺序,置换反应【教学难点】金属化学性质初步探究,利用金属活动性顺序及置换反应解释一些相关的化学问题 金属即有通性,又有特性。物质的用途不仅取决于物质的物理性质,还与物质的化学性质有关。那么,金属有哪些化学性质呢?通过上节课的学习,我们已经知道【想一想】我们学过的铁、镁、铜与氧气反应现象及化学方程式。铁丝在氧气中剧烈燃烧、火星四射、生成一种黑色固体物质、放出大量的热镁带燃烧时,发出耀眼的白光、生成一种白色固体物质、放出大量的热【金属与氧气的反应】铝:4Al+3O2 2Al2O3 剧烈燃烧、发出耀眼白光、银白金属变为白色固体 ①“ 真金不怕火炼”说明金既使在高温下也不与氧气反应。由此可见,并不是所有金属都与氧气反应,除金外,银、铂等金属也不能与氧气反应。② 通过金属与氧气反应的事实也可以得出:镁、铝比较活泼(常温下就与氧气反应)铁、铜次之,金最不活泼。铁: 3Fe+2O2 Fe3O4 剧烈燃烧、火星四射、生成一种黑色固体、放出大量的热 铜:2Cu+O2 2CuO 红色金属变为黑色固体 镁:2Mg+O2 2MgO 剧烈燃烧、发出耀眼白光 . 生成白色粉末状固体、放热 . 【金属与稀盐酸(或稀硫酸)反应】铝跟稀盐酸反应铁跟稀盐酸反应铜跟稀盐酸反应1 、 能与稀盐酸反应,放出氢气,而 却不能。 2 、铁、镁、锌能和稀盐酸或稀硫酸反应时剧烈程度不同。 __ 反应最剧烈其次是 _____ ,然后是 ____ 。Mg > Zn > Fe > Cu>( H )讨论交流:从你的探究中,你的发现或收获? 情景再现Mg 、 Zn 、FeCu镁锌铁【金属与稀盐酸(或稀硫酸)反应】2Al+6HCl==2AlCl3+3H2↑ 2Al+3H2SO4==Al2(SO4)3+3 H2↑ 反应剧烈、产生大量气泡、溶液仍为无色① 由铝铁与稀盐酸(或稀硫酸)反应,而铜不与稀盐酸(或稀硫酸)反应,说明铝铁的金属活动性比铜强,它们能够置换酸中的氢,是活泼金属。② 铁与稀盐酸(或稀硫酸)反应时生成 +2价铁的化合物,命名时读作“亚铁”, FeCl2 名称为氯化亚铁,FeSO4 名称为硫酸亚铁,它们的溶液均呈浅绿色Fe+2HCl==FeCl2+ H2↑ Fe+H2SO4==FeSO4+H2↑反应较慢、有气泡产生、溶液有无色变为浅绿色Cu+HClCu+H2SO4不反应没有明显现象 铝与硫...