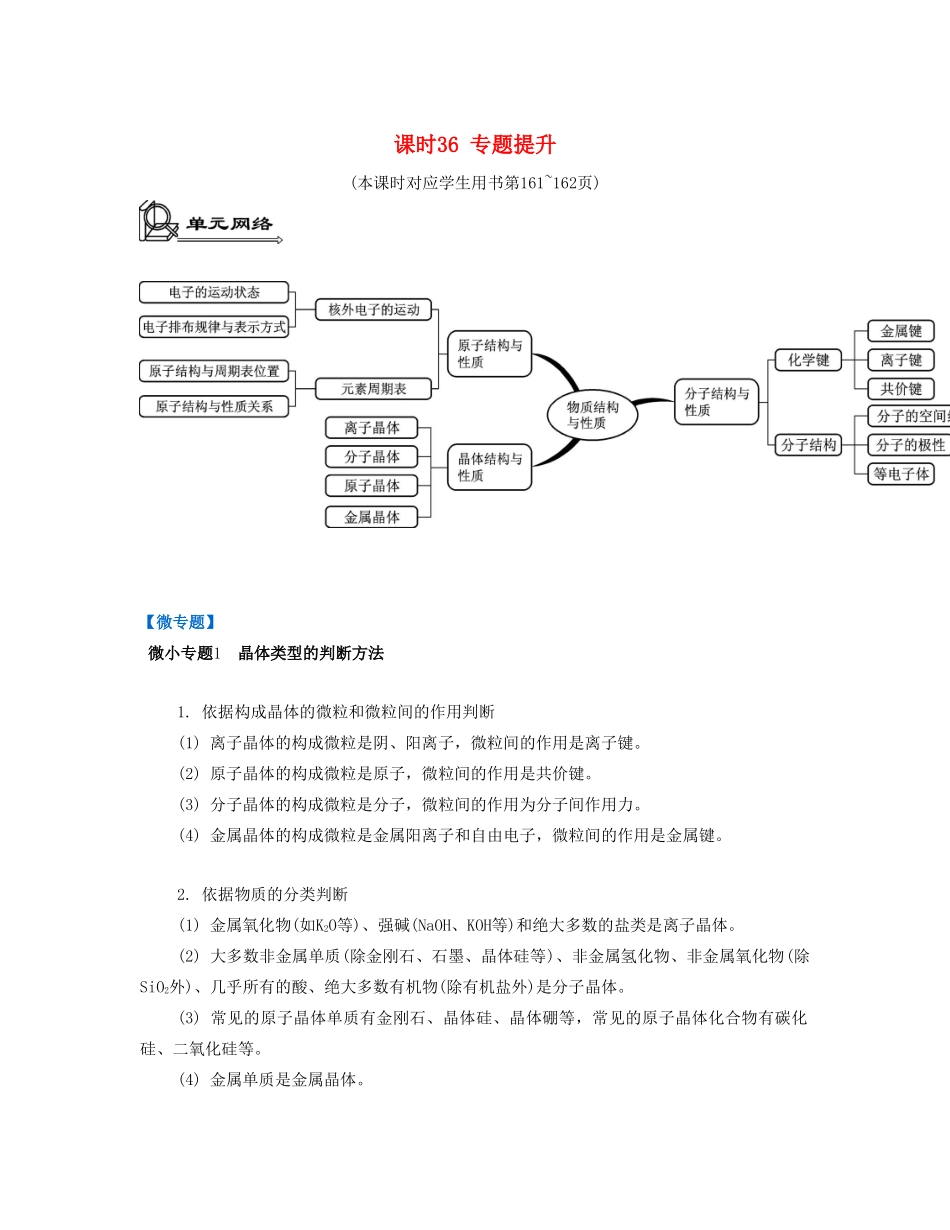
课时36专题提升(本课时对应学生用书第161~162页)【微专题】微小专题1晶体类型的判断方法1.依据构成晶体的微粒和微粒间的作用判断(1)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。(2)原子晶体的构成微粒是原子,微粒间的作用是共价键。(3)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。(4)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。2.依据物质的分类判断(1)金属氧化物(如K2O等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。(3)常见的原子晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有碳化硅、二氧化硅等。(4)金属单质是金属晶体。3.依据晶体的熔点判断(1)离子晶体的熔点较高,常在数百至一千摄氏度。(2)原子晶体的熔点高,常在一千摄氏度至几千摄氏度。(3)分子晶体的熔点低,常在数百摄氏度以下至很低温度。(4)金属晶体多数熔点高,但也有相当低的。4.依据导电性判断(1)离子晶体溶于水形成的溶液及熔融状态时能导电。(2)原子晶体一般为非导体。(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。(4)金属晶体是电的良导体。5.依据硬度和机械性能判断离子晶体硬度较大且脆。原子晶体硬度大。分子晶体硬度小且较脆。金属晶体多数硬度大,但也有较低的,且具有延展性。微小专题2物质的熔、沸点高低的比较方法1.不同类型晶体的熔、沸点高低,存在一般规律:原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。2.原子晶体:由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅。3.离子晶体:一般来说,阴、阳离子所带电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能就越大,其晶体的熔、沸点就越高。4.分子晶体(1)分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。(2)组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。(3)组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。(4)互为同分异构体的物质,支链越多,熔、沸点越低。5.金属晶体:金属离子半径越小,离子所带电荷数越多,其金属键越强,金属熔、沸点就越高。举题说法例题1A、B、C、D、E代表5种元素。请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为。(2)B元素的-1价离子和C元素的+1价离子的电子层结构都与氩相同,B的元素符号为,C的元素符号为。(3)D元素的+3价离子的3d能级为半充满,D的元素符号为,其基态原子的电子排布式为。(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的电子排布式为。【答案】(1)N(2)ClK(3)Fe1s22s22p63s23p63d64s2(或[Ar]3d64s2)(4)Cu1s22s22p63s23p63d104s1(或[Ar]3d104s1)【解析】(1)A元素基态原子的轨道排布图由题意可写成:,可见该元素核外有7个电子,为氮元素,其元素符号为N。(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即26号元素铁。(4)根据题意要求,首先写出电子排布式:1s22s22p63s23p63d104s1,该元素为29号元素Cu。例题2(1)(2014·无锡期末)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是。(2)(2014·启东期末)NiO、FeO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+半径分别为69pm和78pm,则熔点:NiO(填“>”或“<”)FeO。【答案】(1)MgO晶体中所含离子半径小、所带电荷数多,晶格能大(2)>例题3现有几组物质的熔点(℃)数据如下:A组B组C组D组金刚石:3550℃Li:181℃HF:-83℃NaCl:801℃硅晶...