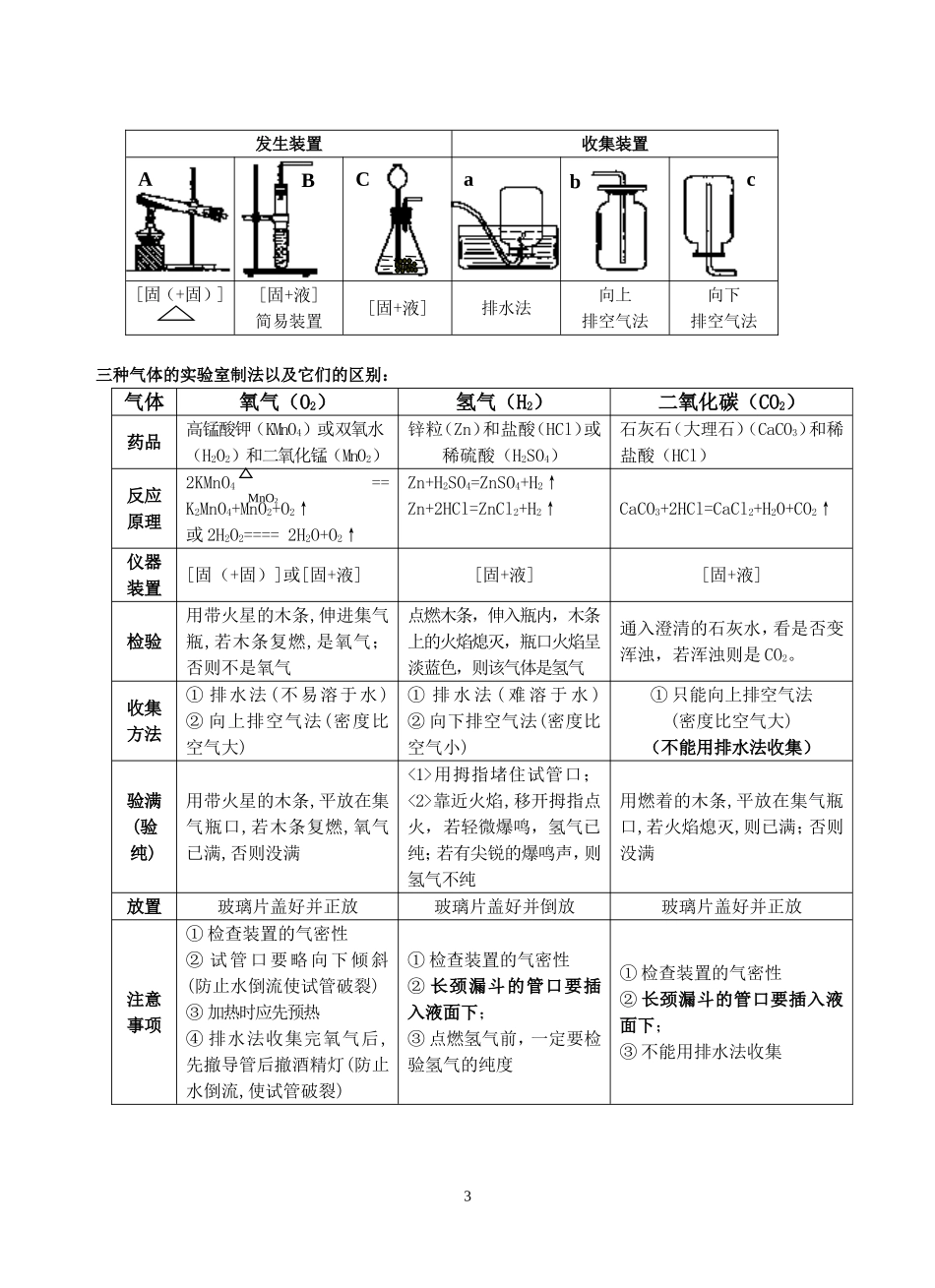
第二章身边的化学物质一、空气中成分研究1.空气中的成分:按体积来分大约为,氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他气体为0.03%。2.空气中氧气含量测定实验(1)实验原理:密闭容器中消耗氧气,不生成新气体,导致压强变小。(2)实验现象:点燃红磷,产生大量的白烟,瓶壁发热;打开止水夹后,烧杯中的水进入锥形瓶中,体积大约占容积的1/5。(3)实验结论:空气中氧气大约占体积的1/5。(4)实验注意事项:①装置气密性好②红磷必须过量③点燃红磷后迅速伸入④等冷却至室温再打开止水夹3.空气中其他气体的性质及用途(1)氮气:通常情况下是一种无色无味气体,难溶于水;化学性质比较稳定,不容易发生化学反应。通常我们使用氮气做保护气,制取化肥,液氮也用于医疗手术。(2)稀有气体:化学性质很稳定,作保护气。氦气由于密度很小,不容易发生爆炸,可以用来做氢气球;作霓虹灯。4.纯净物和混合物的区分:(纯净物与混合物的判断与元素种类数无关)二、氧气的有关内容1.氧气在自然界的循环产生:植物的光合作用消耗:动植物的呼吸作用,燃料的燃烧,缓慢氧化作用2.氧气的性质(1)物理性质:通常情况下,氧气是无色无味的气体;氧气不易溶于水;氧气的密度略大于空气。(2)化学性质:氧气的化学性质比较活泼,能与许多物质发生氧化反应。(助燃性;氧化性)A.氧气与单质反应(碳、硫、磷、氢气)(铜、铁、镁、铝)现象、化学方程式。B.氧气与化合物反应(一氧化碳)现象、化学方程式C.缓慢氧化:如动植物的呼吸、金属的腐蚀、食物的腐败、肥料的腐熟等。3.氧气的用途:①支持燃烧(助燃剂)②提供呼吸4.氧气的制法(1)工业制法(分离液态空气法):利用氧气和氮气的沸点不同(物理变化)(2)实验室制法:A.高锰酸钾制取氧气2KMnO4K2MnO4+MnO2+O2↑B.双氧水和二氧化锰制取氧气2H2O22H2O+O2↑三、二氧化碳的有关内容1.在自然界中的循环产生:动植物的呼吸,燃料的燃烧,微生物的分解作用等。消耗:绿色植物的光合作用,江河湖海的溶解作用2.二氧化碳的性质(1)二氧化碳的物理性质:通常情况下是无色无味气体,密度比空气大,能溶于水,固态二氧化碳(干冰)升华吸热。(2)二氧化碳的化学性质A.二氧化碳不能提供呼吸,不能燃烧也不能支持燃烧B.二氧化碳能与水反应(借助紫色石蕊试液变红来判断)CO2+H2O==H2CO31△△===MnO2===(二氧化碳与水反应生成碳酸,碳酸受热会分解)H2CO3==CO2↑+H2O判断:二氧化碳能使紫色石蕊变红(错)C.与澄清石灰水(即溶质氢氧化钙)反应,产生白色沉淀。CO2+Ca(OH)2==CaCO3↓+H2O;D.与碳高温反应:C+CO2===2CO3.二氧化碳的用途:温室肥料、制汽水、灭火剂、人工降雨4.二氧化碳的制法实验室制法:石灰石或大理石与稀盐酸CaCO3+2HCl==CaCl2+CO2↑+H2O;5.二氧化碳对人体以及环境的影响(1)二氧化碳对人体的影响(不能供呼吸,会造成窒息),但二氧化碳没有毒。减少二氧化碳危害的方法:a.保持室内经常通风;b.进入菜窖(枯井)做灯火试验。(2)二氧化碳对环境影响——温室效应(全球变暖问题)A.温室效应造成气温上升,冰川融化,海平面上升,一些沿海城市会被淹没,有的地方会炎热得无法居住,气温上升,会使更多的水蒸气进入大气,一些富饶的土地变成沙漠。B.防止温室效应的措施:a.减少使用煤、石油、天然气等化学燃料;b.更多的利用太阳能、风能、地热等清洁能源;c.大力植树造林,严禁乱砍滥伐森林;三、水的有关内容1.水污染情况:A.水污染的来源:工业三废排放、农业上农药化肥的任意施用;生活污水的任意排放。B.防止水污染的主要措施:加强对水的管理和对水质的监测;工业三废实行先处理后排放;农业上合理使用化肥和农药;节约用水,提高水的利用效率2.水的组成及性质实验:水的电解实验(负氢正氧二比一)2H2O2H2↑+O2↑现象:1.接通直流电源,出现气泡,正极和负极中气体的体积比大约为1∶22.正极的气体用带火星的木条检验,木条复燃,说明生成了氧气3.负极的气体用燃着的木条检验,气体被点燃,产生淡蓝色火焰,用一个干冷的烧杯放在火焰上方,烧杯内壁出现水珠,说明反应生成了...