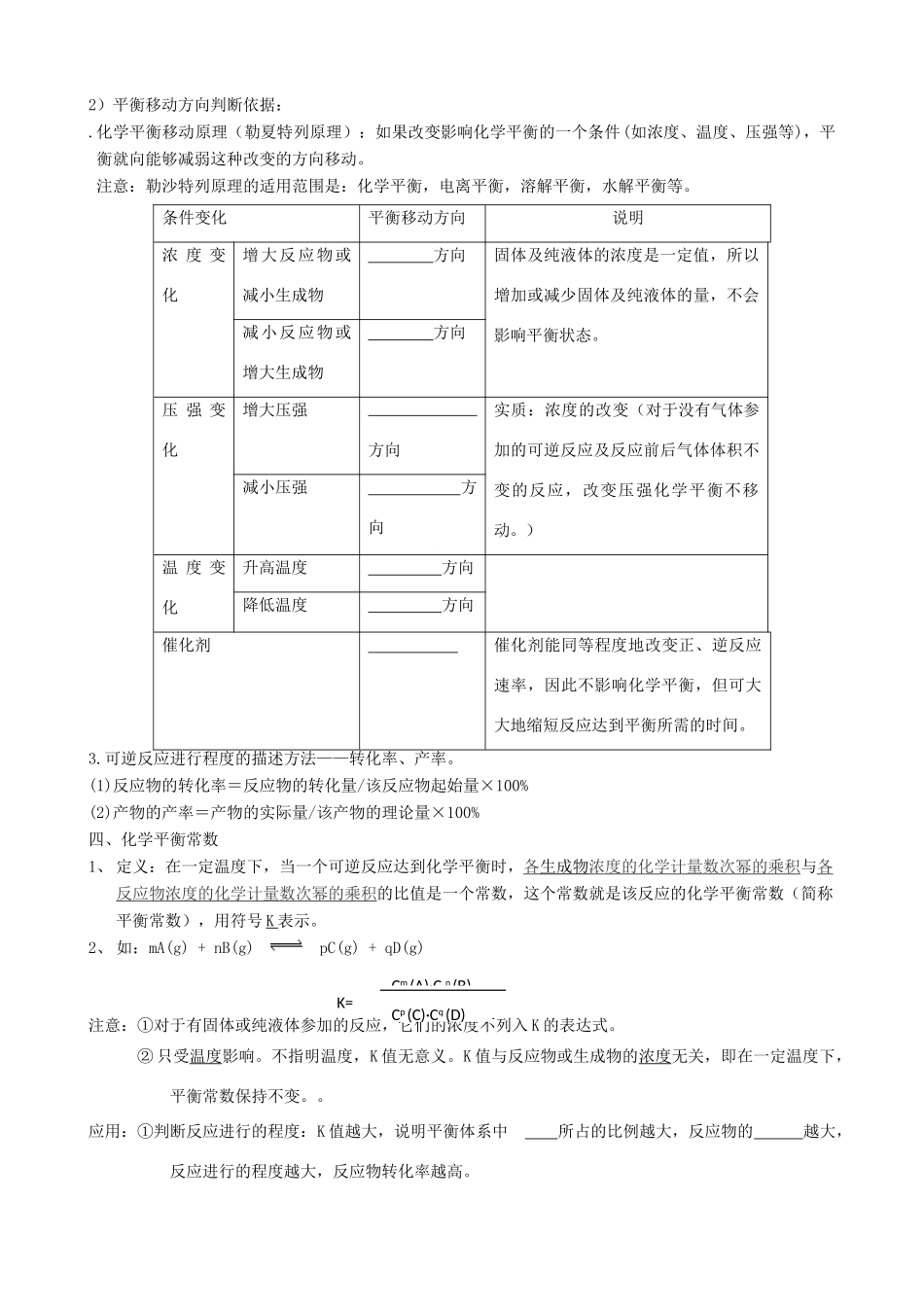
化学反应速率课题元化学反应速率总课时1班级(类型)学习目标1、能说出化学反应速率的概念,准确写出其表达式并理解含义。2、能记住同一化学反应用不同物质表达时的速率之间的关系3、会列三段式并运用解决问题重、难点重难点:三段式的应用。学习环节和内容学生活动教师反思第二章化学反应速率和化学平衡第一节化学反应速率课前预习1.化学反应原理的三个重要组成部分是、、;2.化学反应速率是研究;化学平衡是研究;课堂跟踪一、化学反应速率1、化学反应速率的表示方法:用单位时间内反应物浓度的减少或者生成物浓度的增加来表示。表达式:=(△C—浓度变化量;△t—反应时间)注意点:①同一反应里,用不同物质浓度的改变量来表示反应速率时,其数值,故应标明是哪种物质表示的化学反应速率,但这些数值表示的意义是均表示该化学反应的快慢。②用不同物质表示的化学反应速率之比等于化学方程式中的各物质的化学计量系数比。例:对于反应:mA+nBpC+qDVA∶VB∶VC∶VD=m∶n∶p∶q③熟悉三种浓度:起始浓度:指反应物或生成物开始反应时的浓度。常用c(起始)表示。终了浓度:指反应物或生成物经过一段时间后的浓度。常用c(终了)表示。变化浓度:指化学反应过程中某一段时间内反应物减少的浓度或生成物增加的浓度2、影响化学反应速率的因素。(1)、有效碰撞理论化学反应发生的先决条件是:活化分子能够发生有效碰撞。活化分子:是指反应中能量较高的分子。(其它条件不变时,对某一反应而言,活化分子在反应物分子中所占的比例是不变的)有效碰撞概念:活化分子相互碰撞时,且有合适的取向时,使化学键断裂,发生化学反应,这样的碰撞叫做有效碰撞。(2)、影响反应速率因素①内因(主要因素)是指参加反应的物质的性质。②外界条件对化学反应速率的影响:反应物的浓度、压强、温度、催化剂等同一化学反应的速率大小与外界条件(外因)有关。具体规律如下:二、化学平衡1.化学平衡状态概念:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。2平衡状态下的可逆反应,改变条件时平衡移动方向的判断1)、平衡移动的根本原因是V正≠V逆,通过比较速率,可判断平衡移动方向当V正>V逆时,平衡向正反应方向移动当V正<V逆时,平衡向逆反应方向移动2)平衡移动方向判断依据:.化学平衡移动原理(勒夏特列原理):如果改变影响化学平衡的一个条件(如浓度、温度、压强等),平衡就向能够减弱这种改变的方向移动。注意:勒沙特列原理的适用范围是:化学平衡,电离平衡,溶解平衡,水解平衡等。条件变化平衡移动方向说明浓度变化增大反应物或减小生成物方向固体及纯液体的浓度是一定值,所以增加或减少固体及纯液体的量,不会影响平衡状态。减小反应物或增大生成物方向压强变化增大压强方向实质:浓度的改变(对于没有气体参加的可逆反应及反应前后气体体积不变的反应,改变压强化学平衡不移动。)减小压强方向温度变化升高温度方向降低温度方向催化剂催化剂能同等程度地改变正、逆反应速率,因此不影响化学平衡,但可大大地缩短反应达到平衡所需的时间。3.可逆反应进行程度的描述方法——转化率、产率。(1)反应物的转化率=反应物的转化量/该反应物起始量×100%(2)产物的产率=产物的实际量/该产物的理论量×100%四、化学平衡常数1、定义:在一定温度下,当一个可逆反应达到化学平衡时,各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示。2、如:mA(g)+nB(g)pC(g)+qD(g)注意:①对于有固体或纯液体参加的反应,它们的浓度不列入K的表达式。②只受温度影响。不指明温度,K值无意义。K值与反应物或生成物的浓度无关,即在一定温度下,平衡常数保持不变。。应用:①判断反应进行的程度:K值越大,说明平衡体系中所占的比例越大,反应物的越大,反应进行的程度越大,反应物转化率越高。Cm(A)·Cn(B)Cp(C)·Cq(D)K=②判断反应热效应:T升高,K值增大,则正反应为吸热反应。T降低,K值减小,则正反应为放热反应。4化学平衡常数数值的大...