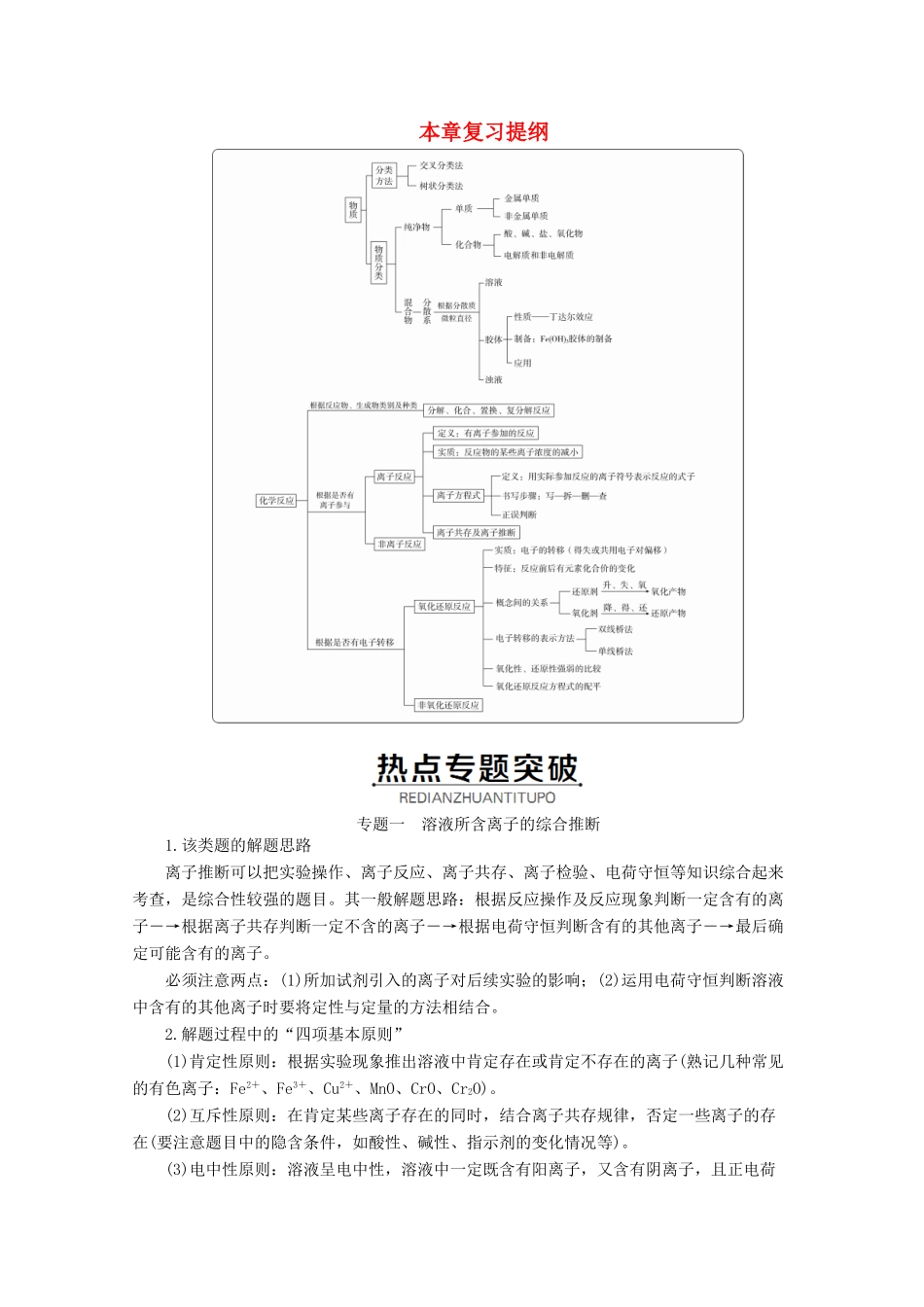
本章复习提纲专题一溶液所含离子的综合推断1.该类题的解题思路离子推断可以把实验操作、离子反应、离子共存、离子检验、电荷守恒等知识综合起来考查,是综合性较强的题目。其一般解题思路:根据反应操作及反应现象判断一定含有的离子―→根据离子共存判断一定不含的离子―→根据电荷守恒判断含有的其他离子―→最后确定可能含有的离子。必须注意两点:(1)所加试剂引入的离子对后续实验的影响;(2)运用电荷守恒判断溶液中含有的其他离子时要将定性与定量的方法相结合。2.解题过程中的“四项基本原则”(1)肯定性原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子(熟记几种常见的有色离子:Fe2+、Fe3+、Cu2+、MnO、CrO、Cr2O)。(2)互斥性原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在(要注意题目中的隐含条件,如酸性、碱性、指示剂的变化情况等)。(3)电中性原则:溶液呈电中性,溶液中一定既含有阳离子,又含有阴离子,且正电荷总数与负电荷总数相等(这一原则可帮助我们确定一些隐含的离子)。(4)进出性原则:通常在实验过程中使用,是指在实验过程中生成的离子或引入的离子对后续实验的干扰。1某兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:检测次数溶液中检测出的物质第一次KCl、K2SO4、Na2CO3、NaCl第二次KCl、BaCl2、Na2SO4、K2CO3第三次Na2SO4、KCl、K2CO3、NaCl(1)三次检测结果中第________次检测结果不正确。(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子(提示:Ag2SO4微溶于水),该小组进行了如下操作:第一步向溶液中滴加过量的________(填化学式)溶液,其目的是检验CO并将其除去;第二步加入过量的Ba(NO3)2溶液,其目的是________________________;第三步过滤,再向滤液中加入________(填化学式)溶液,发生反应的离子方程式为________________________________________________________。[批注点拨][解析](1)溶液中,BaCl2可分别与Na2SO4、K2CO3反应生成BaSO4、BaCO3沉淀,故第二次检测结果不正确。(2)SO的检验可用硝酸钡溶液,产生白色沉淀,CO可产生干扰,后面还要检验Cl-,故用硝酸检验CO并将其除去;Cl-的检验用硝酸银溶液,产生白色沉淀,SO会对Cl-的检验产生干扰,故应先检验SO并将其除去。[答案](1)二(2)HNO3检验SO,并将其除去AgNO3Ag++Cl-===AgCl↓专题二氧化还原反应的基本规律及应用1.守恒规律还原剂失电子总数=氧化剂得电子总数或氧化剂化合价降低的总数=还原剂化合价升高的总数。应用:氧化还原反应化学方程式的配平。(1)配平方法——化合价升降法(2)示例①配平化学方程式H2S+HNO3―→S↓+NO↑+H2O第一步:标变价,H2S+HNO3―→S↓+NO↑+H2O故H2S的化学计量数为3,NO的化学计量数为2。第四步:配化学计量数,先配平变价元素,再利用原子守恒配平其他元素。3H2S+2HNO3===3S↓+2NO↑+4H2O第五步:查守恒,利用O原子守恒来进行验证。a.先配平含变价元素物质的化学计量数:该氧化还原反应中的变价元素为Cu和N,则有Cu(0)→Cu(+2)化合价升2×3N(+5)→N(+2)化合价降3×2b.根据原子守恒,用观察法确定其他物质的化学计量数。化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。2.价态规律(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。应用:判断元素或物质的氧化性、还原性。示例:Fe3+处于最高价态,只有氧化性;Fe2+处于中间价态,既有氧化性,又有还原性;Fe处于最低价态,仅有还原性。(2)价态归中规律:同种元素不同价态的原子之间发生氧化还原反应时,高价态+低价态―→中间价态;即“只靠拢,不交叉”。应用:判断元素在生成物中的价态。示例:反应:H2S+H2SO4(浓)===S↓+SO2↑+2H2OS是氧化产物,SO2是还原产物2下列微粒中,各物质均既有氧化性又有还原性的一组是()A.I2、Br-、H+B.S、Na+、KC.I2、NO2、H2OD.I-、Fe3+、HCl[批注点拨][解析]元素处于中间价态时,既有氧化性又有还原性。[答案]C3下列反应中,电子转移方向和数目正确的是()[批注点拨][解析]A项,硫元素失去电...