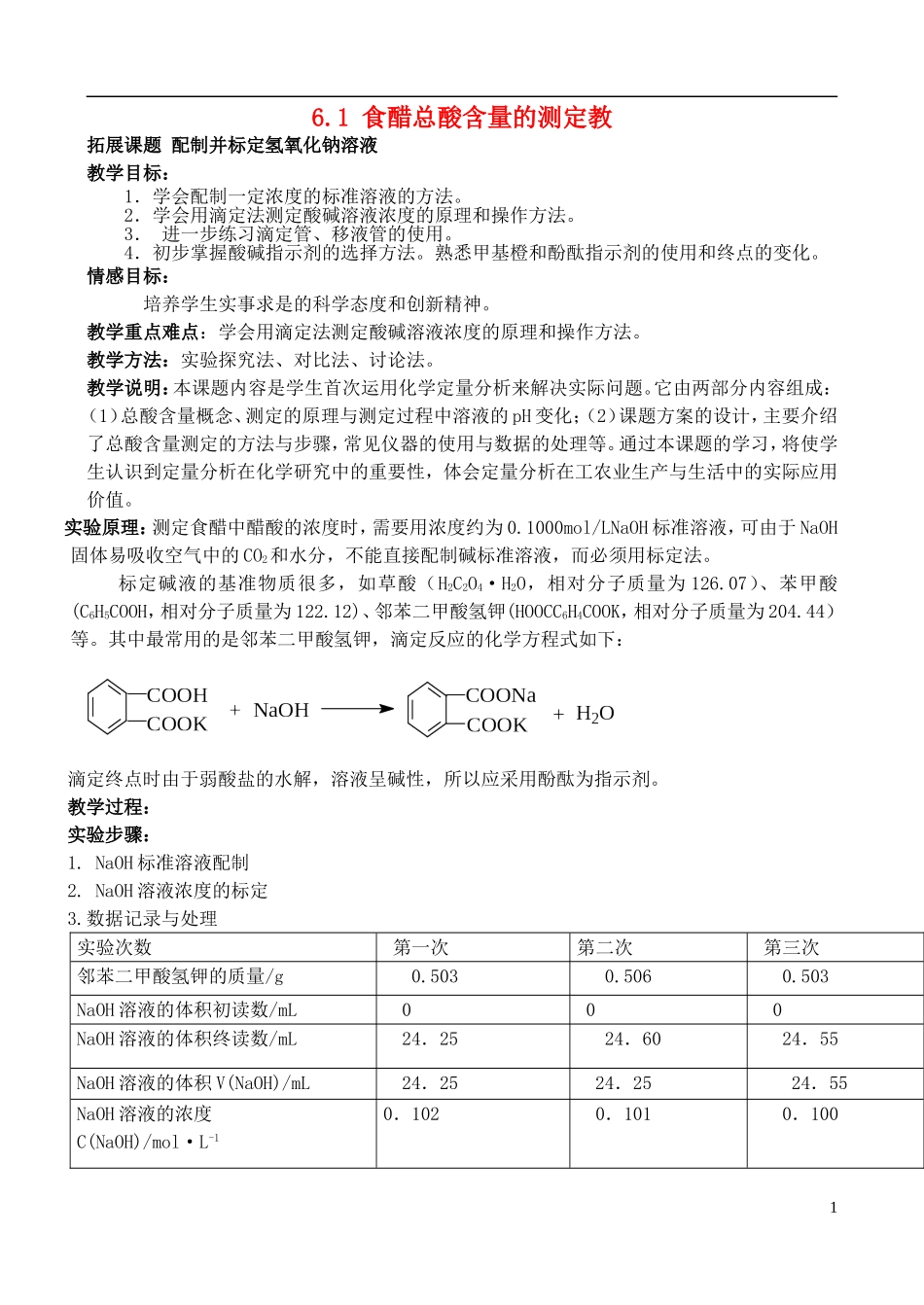
6.1食醋总酸含量的测定教拓展课题配制并标定氢氧化钠溶液教学目标:1.学会配制一定浓度的标准溶液的方法。2.学会用滴定法测定酸碱溶液浓度的原理和操作方法。3.进一步练习滴定管、移液管的使用。4.初步掌握酸碱指示剂的选择方法。熟悉甲基橙和酚酞指示剂的使用和终点的变化。情感目标:培养学生实事求是的科学态度和创新精神。教学重点难点:学会用滴定法测定酸碱溶液浓度的原理和操作方法。教学方法:实验探究法、对比法、讨论法。教学说明:本课题内容是学生首次运用化学定量分析来解决实际问题。它由两部分内容组成:(1)总酸含量概念、测定的原理与测定过程中溶液的pH变化;(2)课题方案的设计,主要介绍了总酸含量测定的方法与步骤,常见仪器的使用与数据的处理等。通过本课题的学习,将使学生认识到定量分析在化学研究中的重要性,体会定量分析在工农业生产与生活中的实际应用价值。实验原理:测定食醋中醋酸的浓度时,需要用浓度约为0.1000mol/LNaOH标准溶液,可由于NaOH固体易吸收空气中的CO2和水分,不能直接配制碱标准溶液,而必须用标定法。标定碱液的基准物质很多,如草酸(H2C2O4·H2O,相对分子质量为126.07)、苯甲酸(C6H5COOH,相对分子质量为122.12)、邻苯二甲酸氢钾(HOOCC6H4COOK,相对分子质量为204.44)等。其中最常用的是邻苯二甲酸氢钾,滴定反应的化学方程式如下:滴定终点时由于弱酸盐的水解,溶液呈碱性,所以应采用酚酞为指示剂。教学过程:实验步骤:1.NaOH标准溶液配制2.NaOH溶液浓度的标定3.数据记录与处理实验次数第一次第二次第三次邻苯二甲酸氢钾的质量/g0.5030.5060.503NaOH溶液的体积初读数/mL000NaOH溶液的体积终读数/mL24.2524.6024.55NaOH溶液的体积V(NaOH)/mL24.2524.2524.55NaOH溶液的浓度C(NaOH)/mol·L-10.1020.1010.1001NaOH溶液浓度的平均值/mol·L-10.101相对平均偏差/%0.66%注意事项:(1)称量邻苯二甲酸氢钾时,所用锥形瓶外壁要干燥并编号(以后称量同)。(2)NaOH饱和溶液侵蚀性很强,长期保存最好用聚乙烯塑料化学试剂瓶贮存(用一般的饮料瓶会因被腐蚀而瓶底脱落)。在一般情况下,可用玻璃瓶贮存,但必须用橡皮塞。(3)NaOH标准溶液配制时,一定量蒸馏水中所加NaOH饱和溶液的量随室温的不同而变化,因氢氧化钠在不同温度下的溶解度有差异。夏天(30℃)大约是5.6mL饱和氢氧化钠溶液加新煮沸而迅速冷却的蒸馏水到1000mL;春秋天(21℃)大约是6.2mL饱和氢氧化钠溶液加新煮沸而迅速冷却的蒸馏水到1000mL;冬天(10℃)大约是6.7mL饱和氢氧化钠溶液加新煮沸而迅速冷却的蒸馏水到1000mL。2