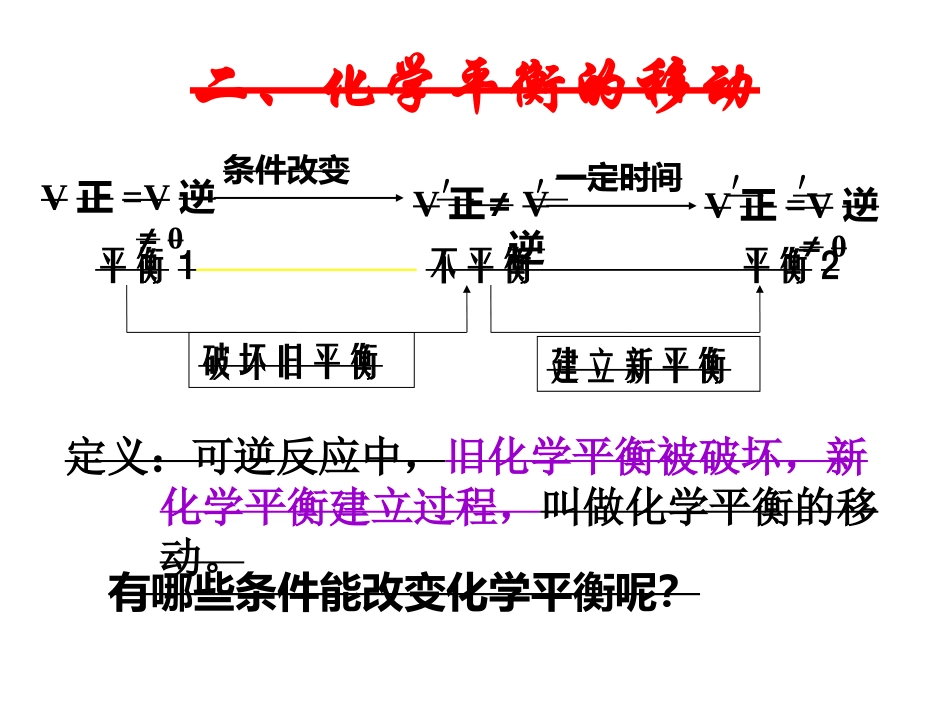
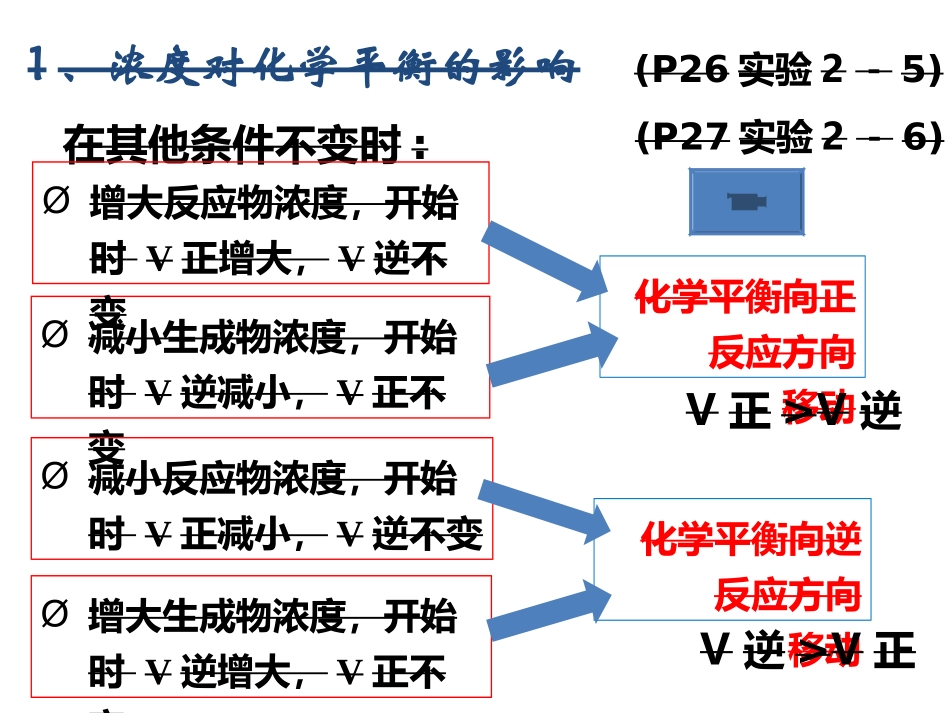
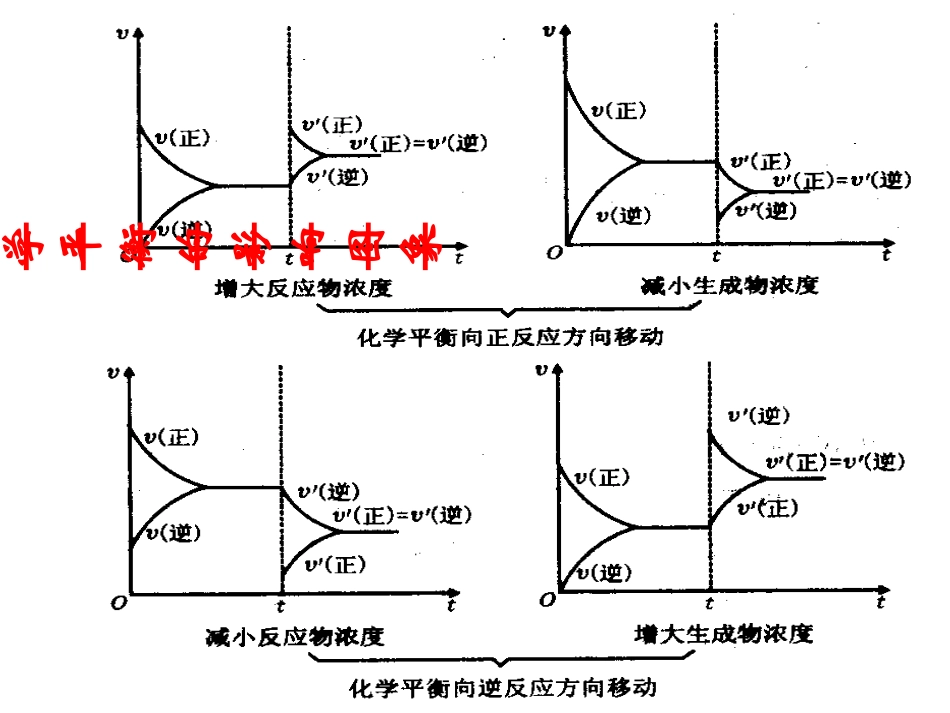
定义:可逆反应中,旧化学平衡被破坏,新化学平衡建立过程,叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变平衡1不平衡平衡2建立新平衡破坏旧平衡V正=V逆≠0′′一定时间二、化学平衡的移动′′有哪些条件能改变化学平衡呢?1、浓度对化学平衡的影响化学平衡向逆反应方向移动在其他条件不变时:Ø减小生成物浓度,开始时V逆减小,V正不变Ø增大反应物浓度,开始时V正增大,V逆不变化学平衡向正反应方向移动Ø减小反应物浓度,开始时V正减小,V逆不变Ø增大生成物浓度,开始时V逆增大,V正不变(P26实验2-5)(P27实验2-6)V正>V逆V逆>V正浓度对化学平衡的影响图象Ø浓度对化学平衡移动的几个注意点①对平衡体系中的固态和纯液态物质,其浓度可看作一个常数,增加或减小固态或液态纯净物的量并不影响V正、V逆的大小,所以化学平衡不移动。②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应速率一定大于原平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。③反应物有两种或两种以上,增加一种物质的浓度,该物质的平衡转化率降低,而其他物质的转化率提高。④改变浓度后,速率-时间图象是连续的。应用1.在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本2SO2(g)+O2(g)SO3(g)的平衡体系中,为了提高SO2的利用率,可采用什么措施?催化剂2.可逆反应H2O(g)+C(s)CO(g)+H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度②加入更多的碳③增加H2浓度①平衡正向移动,CO浓度增大②平衡不移动,CO浓度不变③平衡逆向移动,CO浓度减小2、温度对化学平衡的影响在其它条件不变的情况下:Ø温度升高,V正、V逆都增大,平衡向着吸热反应的方向移动Ø温度降低,V正、V逆都减小,平衡向着放热反应的方向移动V正=V逆V正V逆t1t(s)V(molL-1S-1)0V”正=V”逆V’逆V‘正2NO2N2O4(正反应是放热反应)升高温度t2注意:温度对平衡的影响,图像具有不连续性。为什么?(P28实验2-7)温度对化学平衡的影响图象练习A、保持容积不变,加入HBr(g)B、降低温度C、升高温度D、保持容积不变,加入H2(g)(AC)在高温下,反应(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是2HBr(g)H2(g)+Br2(g)V正=V逆V正V逆t1t(s)V(molL-1S-1)0t2V”正=V”逆V’逆V‘正增大压强aA(g)+bB(g)cC(g)+dD(g)(a+b>c+d)注意:压强对平衡的影响,图像具有不连续性。为什么?3、压强对化学平衡的影响:增大压强,正逆反应速率均增大,但增大倍数不一样,平衡向着体积缩小的方向移动.减小压强,正逆反应速率均减小,但减小倍数不一样,平衡向着体积增大的方向移动。在其它条件不变时,增大压强,V正、V逆都增大,但增大倍数不一样。化学平衡向着气体体积缩小的方向移动,减小压强,V正、V逆都减小,但减小倍数不一样。化学平衡向着气体体积增大的方向移动。增大压强,正逆反应速率均增大,但增大倍数一样,V’正=V’逆,平衡不移动。减小压强,V正、V逆都减小,但减小倍数一样。平衡不移动2、对于反应前后气体体积发生变化的化学反应aA(g)+bB(g)cC(g)+dD(g)(a+b≠c+d)1、对于反应前后气体体积没有发生变化的化学反应高温H2O+COH2+CO2Ø在T、P不变时充入不反应的气体Ø在T、V不变时充入不反应的气体V正、V逆不变,平衡不移动相当于减小压强,V正、V逆都减小,但减小倍数不一样。化学平衡向着气体体积增大的方向移动。规律:对于反应前后气体总体积相等的可逆反应,改变压强只改变化学反应速率,而对平衡无影响.例:对如下平衡A(气)+B(气)2C(气)+D(固)0t1t2t3加压对化学平衡的影响V正V正′=V逆′V逆V正′=V逆′V正V逆0t1t2t3减压对化学平衡的影响(实验2-8)2NO2N2O4改变压强,观察混合气体颜色变化练习:下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?①2NO(g)+O2(g)2NO2(g)②H2O(g)+CO(g)CO2(g)+H2(g)③H2O(g)+C(s)CO(g)+H2(g)④CaCO3(s)CaO(s)+CO2(g)⑤H2S(g)H2(g)+S(s)正向移动不移动逆向移动逆向移动不移动四、催化剂对化学平衡的影响:同等...