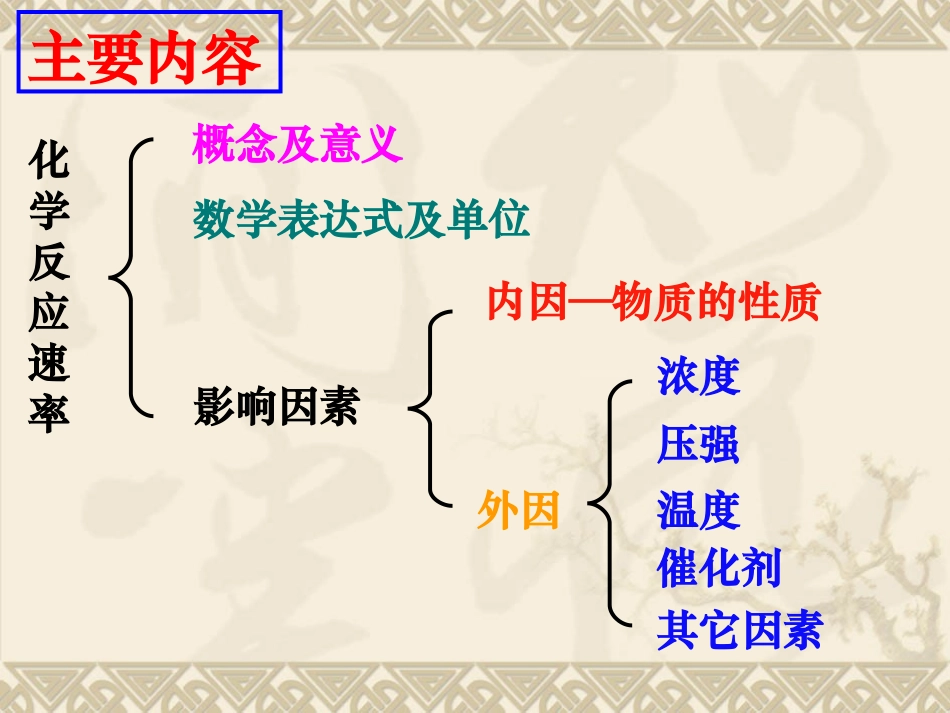
高三化学专题复习高三化学专题复习化学反应速率和化学平衡化学反应速率和化学平衡主要内容化学反应速率概念及意义数学表达式及单位影响因素内因—物质的性质外因浓度压强温度催化剂其它因素一、化学反应速率一、化学反应速率1.定义:2.表示方法:3.数学表达式:4.单位:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。mol/(L·s)或mol(L·min)-1或mol·L-1·h-1衡量化学反应进行的快慢程度的物理量。v=△△CC△△tt——————★1.反应速率是指某一时间间隔内的平均反应速率,而不是某一时刻的瞬时速率;★2.同一化学反应的反应速率用不同的物质来表示,可能有不同的速率值,但这些速率的数值之比等于化学方程式的计量系数之比5.应注意的几个重要的问题:对于反应:mA+nB=pC+qD比例关系:V(A):V(B):V(C):V(D)=m:n:p:q★4.温度每升高10℃,反应速率增至原来的2-4倍。★3.比较同一反应在不同条件下的反应速率时,应:①统一基准物质;②统一单位。总结:比较化学反应速率的大小:(1)利用化学反应速率比较反应进行的快慢,必须先转化为同一物质表示的反应速率,再进行比较。同时还注意化学反应速率单位的一致性.(2)利用化学反应中各物质的化学反应速率之比等于各物质的化学计量数之比。(3)应用“三段式”来解决较为复杂的反应速率问题。【例1】反应A+3B=2C+2D在四种不同情况下的反应速率分别为:v(A)=0.15mol/(L·s);v①②(B)=0.6mol/(L·s)v(C)=24mol/(L·min);v③④(D)=0.45mol/(L·s)则该反应进行的快慢顺序为。④>=>③②①【例2】在2L容器中,发生3A+B=2C的反应,若最初加入的A和B均为4mol,A的平均反应速率为0.12mol/(L·s),则10s后容器内的B物质是()A.2.8molB.1.6molC.3.2molD.3.6molC典型例题解析【例3】某温度时,在某温度时,在2L2L容器中容器中XX、、YY、、ZZ三种物三种物质的物质的量随时间的变质的物质的量随时间的变化曲线如右图所示,由图化曲线如右图所示,由图中数据分析,该反应的化中数据分析,该反应的化学方程式为:学方程式为:______________________________反应开始至反应开始至2min2min,,ZZ的平均反应速率为的平均反应速率为____________________。。典型例题解析n/molt/min1230.10.20.30.40.50.60.70.80.91.01.11.2YYXXZZ3X+Y2Z0.05mol/(L·min)1、内因:参加化学反应的物质的性质(即反应物的本性)(内因是影响化学速率的主要因素)2、外因当其他条件不变时(1)浓度的影响:增加反应物的浓度可以加快化学反应速率;降低反应物的浓度,可以减慢化学反应速率。二、影响化学速率的因素二、影响化学速率的因素(2)压强的影响:(仅适用于有气体参加的反应)增加体系的压强,可以加快化学反应速率;降低体系的压强,可以减慢化学反应速率。(3)温度的影响:升高体系的温度可以加快化学反应速率;降低体系的温度,可以减慢化学反应速率。(4)催化剂的影响:使用正催化剂可以加快化学反应速率;使用负催化剂可以减慢化学反应速率。(5)其他因素的影响:如:光、固体的表面积、溶剂等。特别提醒一、浓度问题一、浓度问题1、若增加一种物质的浓度浓度(无论是反应物或是生成物),反应速率总是加快,反之则减慢。2、固体(或纯液体)的浓度视为常数,增加或减少固体(或纯液体)的量,化学反应速率和化学平衡均不改变;故不能用它表示反应速率。但固体的表面积越大,反应速率越快。本质:压强的变化,引起容器体积的变化,最终导致浓度的变化!如:气体体系中每一种物质的浓度均增大一倍,即体系体积缩小一半,即相当于“加压”了。(1)对于可逆反应,压强增大,正逆反应速率都增大,但压强对平衡体系中气体的系数大的一边影响的幅度大;(2)充入反应无关气体(惰气):恒容条件下,容器总压尽管增大了,但容器的体积不变,各自的浓度也不变,故反应速率不变;恒压条件下,为维持容器压强不变,容器体积必增大,故体系中各气体浓度减小,故反应速率减小。二、压强问题压强对于有气体参与的反应才有意义!反应反应C(s)+HC(s)+H22O(g)CO(g)+HO(g)CO(g)+H22(g)(g)在可变容在可变容积的密闭容器中进行下列的改变,对化学反应积的密...