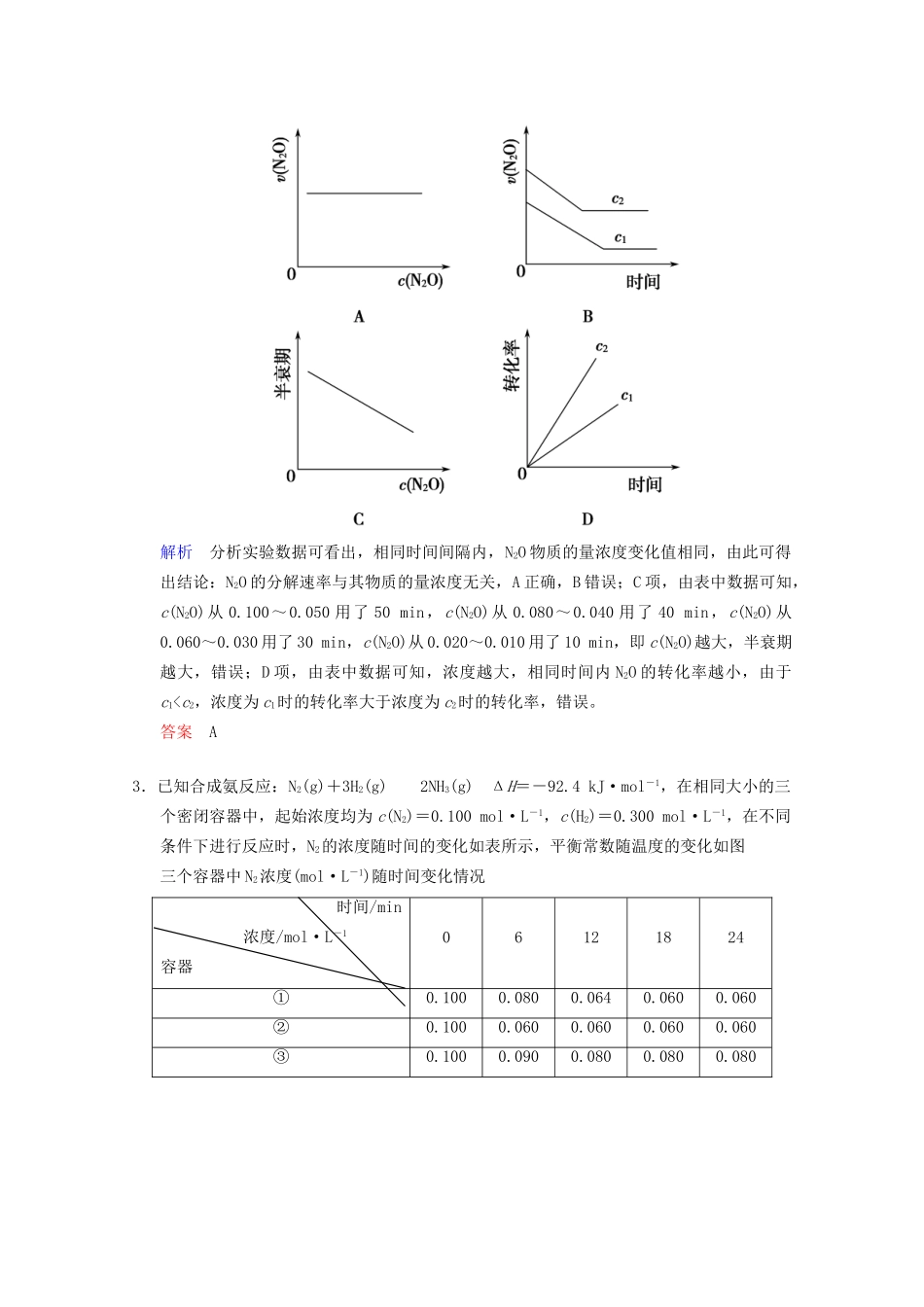
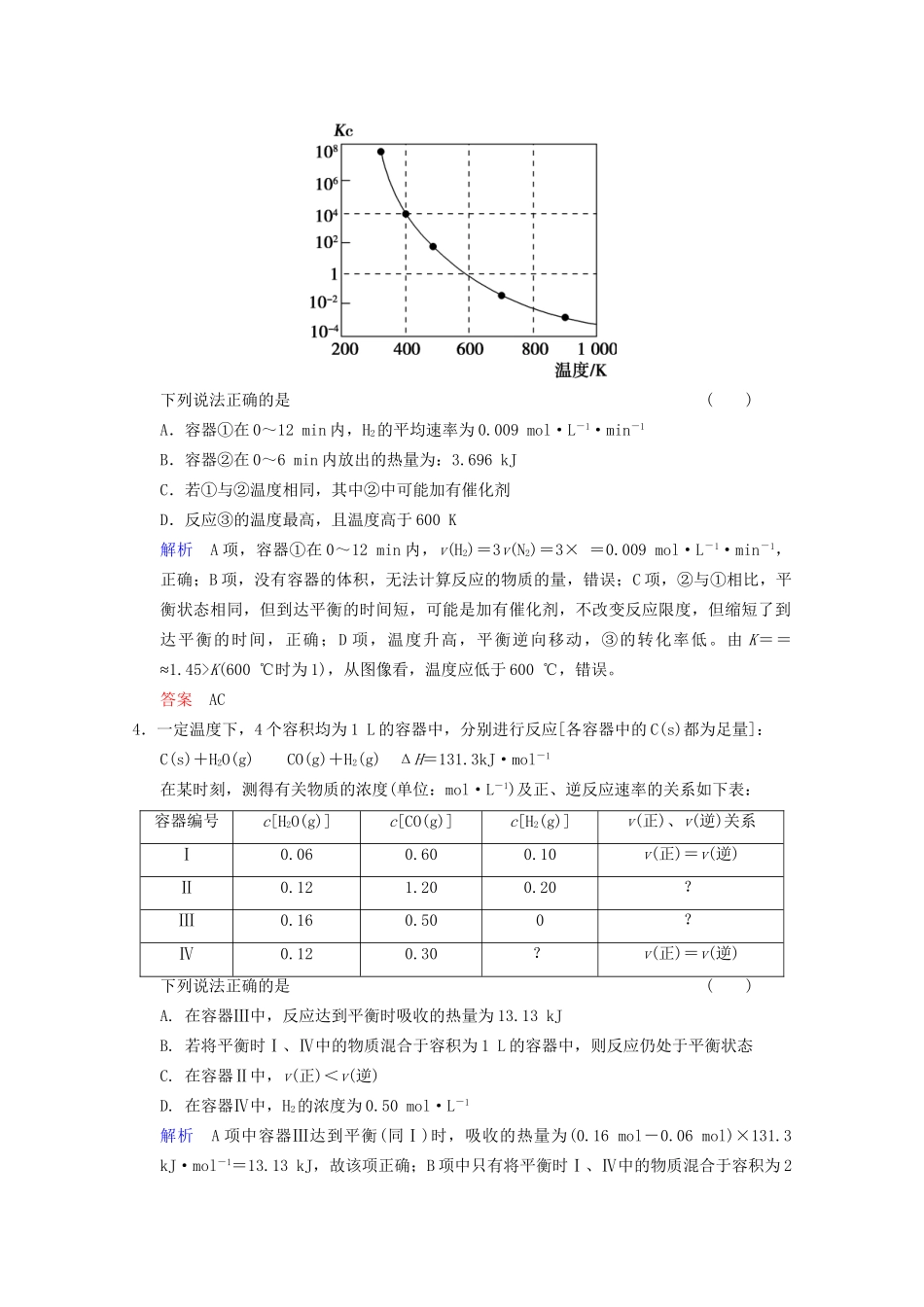
【创新设计】(江苏专用)高考化学二轮题型专攻微题型13化学反应速率与化学平衡原理的综合应用(含新题,含解析)[题型专练]1.为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:编号纯锌粉质量0.2mol·L-1硫酸体积温度硫酸铜固体质量Ⅰ2.0g10.0mL25℃0Ⅱ2.0g10.0mLt℃0Ⅲ2.0g10.0mL35℃0.2gⅣ2.0g10.0mL35℃4.0g下列推断合理的是()A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快C.根据该方案,还可以探究硫酸浓度对反应速率的影响D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ解析A项,根据控制变量法,若选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,温度必须控制在35℃,错误,B项,收集相同条件下等体积的气体所需时间越长,则反应速率越慢,错误;C项,三个实验中硫酸的浓度均相同,故无法探究硫酸浓度对反应速率的影响,错误;D项,本题影响反应速率大小的主要因素是温度和硫酸铜固体的质量,由A项分析可知实验Ⅱ温度应为35℃,则反应速率Ⅱ>Ⅰ,实验Ⅲ,锌与置换出的铜构成原电池。反应速率比Ⅱ快,实验Ⅳ中由于CuSO4过多,置换出的铜可能覆盖在锌表面而阻止反应的进行,使反应速率大大减小,故四个反应的反应速率大小关系可能为Ⅲ>Ⅱ>Ⅰ>Ⅳ。答案D2.在一定条件下,N2O分解的部分实验数据如下:反应时间/min0102030405060708090100c(N2O)/(mol·L-1)0.1000.0900.0800.0700.0600.0500.0400.0300.0200.0100.000下图能正确表示该反应有关物理量变化规律的是()(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1K(600℃时为1),从图像看,温度应低于600℃,错误。答案AC4.一定温度下,4个容积均为1L的容器中,分别进行反应[各容器中的C(s)都为足量]:C(s)+H2O(g)CO(g)+H2(g)ΔH=131.3kJ·mol-1在某时刻,测得有关物质的浓度(单位:mol·L-1)及正、逆反应速率的关系如下表:容器编号c[H2O(g)]c[CO(g)]c[H2(g)]v(正)、v(逆)关系Ⅰ0.060.600.10v(正)=v(逆)Ⅱ0.121.200.20?Ⅲ0.160.500?Ⅳ0.120.30?v(正)=v(逆)下列说法正确的是()A.在容器Ⅲ中,反应达到平衡时吸收的热量为13.13kJB.若将平衡时Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态C.在容器Ⅱ中,v(正)<v(逆)D.在容器Ⅳ中,H2的浓度为0.50mol·L-1解析A项中容器Ⅲ达到平衡(同Ⅰ)时,吸收的热量为(...