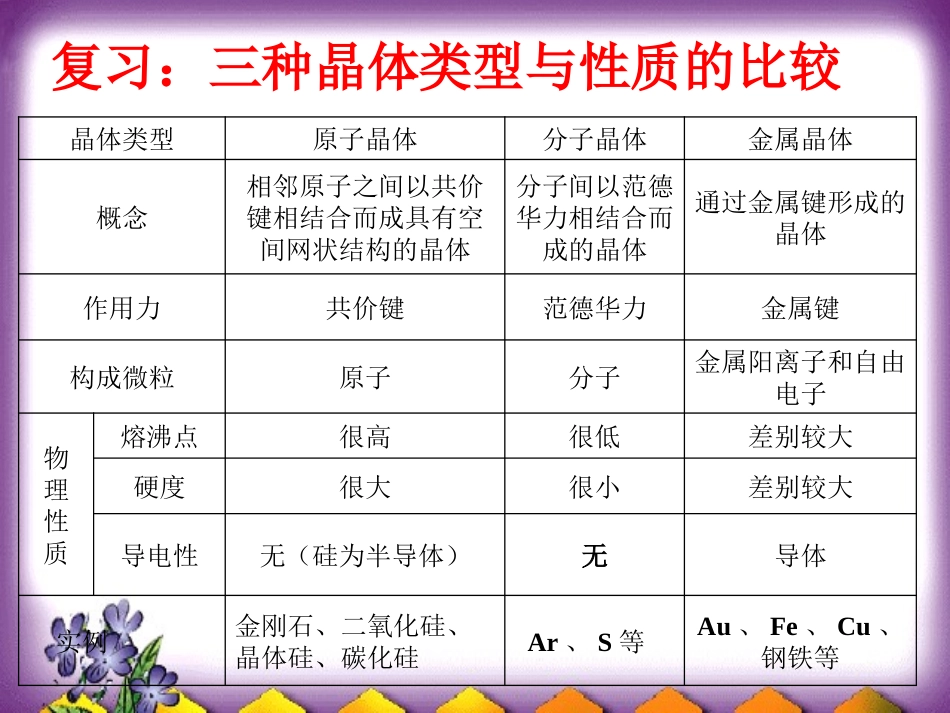
复习:三种晶体类型与性质的比较晶体类型原子晶体分子晶体金属晶体概念相邻原子之间以共价键相结合而成具有空间网状结构的晶体分子间以范德华力相结合而成的晶体通过金属键形成的晶体作用力共价键范德华力金属键构成微粒原子分子金属阳离子和自由电子物理性质熔沸点很高很低差别较大硬度很大很小差别较大导电性无(硅为半导体)无导体实例金刚石、二氧化硅、晶体硅、碳化硅Ar、S等Au、Fe、Cu、钢铁等第四节第四节离子晶体离子晶体晶体氯化钠干冰金刚石熔点(℃)801-56.23550材料:材料:材料:材料:思考:为什么氯化钠的性质与干冰、金刚石的不同?2Na+Cl2==2NaCl+11+17+17+11Na+Cl-NaClCl-Na+氯化钠的晶体结构讨论仔细观察NaCl晶胞,计算一个晶胞实际拥有的Na+和Cl-各是多少个?---Cl----Na+NaCl的晶体结构模型离子晶体一、定义:由阳离子和阴离子通过离子键结合而成的晶体。成键粒子:阴、阳离子相互作用力:离子键离子晶体的配位数:一个离子周围最邻近的异电性离子的数目。离子晶体•离子键无方向性和饱和性,在离子晶体中正、负离子尽可能地与异号离子接触,采用最密堆积。•离子晶体可以看作大离子进行等径球密堆积,小离子填充在相应空隙中形成的。•离子晶体多种多样,但主要可归结为3种基本结构型式。1、NaCl的晶体结构模型---Cl----Na+NaCl晶体中阴、阳离子配位数分别是多少?CsCl的晶体结构模型---Cs+---Cl-2、CsCl的晶体结构示意图晶体中阴、阳离子配位数分别是多少?3、ZnS晶体结构晶体中阴、阳离子配位数分别是多少?科学探究:找出CsCl、NaCl、ZnS三种离子晶体中阳离子和阴离子的配位数,它们是否相等?离子晶体阴离子的配位数阳离子的配位数NaClCsClZnS668844科学探究:你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。NaCl六配位,CsCl八配位,ZnS四配位,为何配位数不同?1、离子晶体稳定存在的条件+++++不稳定a)同号阴离子相切,异号离子相离。配位数与r+/r-的关系+---++++-b)同号离子相离,异号离子相切。稳定----+++++c)同号阴离子相切,异号离子相切。介稳状态r+/r-与配位数从六配位的介稳状态出发,探讨半径比与配位数之间的关系。0.414rrr1)2(r)r(22)r2(rAC2AB下图所示,六配位的介稳状态的中间一层的俯视图。ADBC是正方形。ABCD+++ADCB+0.414rr结论时,配位数为6。此时,为介稳状态,见下面左图。如果r+再大些:----+++++则出现b)种情况,见下面右图,即离子同号相离,异号相切的稳定状态。+---++++-2、r+/r-与配位数ABCDABCD下图所示,八配位的介稳状态的对角面图。ABCD是矩形。当r+继续增加,达到并超过时,即阳离子周围可容纳更多阴离子时,为8配位。7320.rr7320.rr可以求得结论为0.414——0.732,6配位NaCl式晶体结构。rr八配位的半径比与配位数之间的关系总之,配位数与r+/r-之比相关:0.225——0.4144配位ZnS式晶体结构0.414——0.7326配位NaCl式晶体结构0.732——1.0008配位CsCl式晶体结构若r+再增大,可达到12配位;r+再减小,则形成3配位。若r+变小,当,则出现a)种情况,如右图。阴离子相切,阴离子阳离子相离的不稳定状态。配位数将变成4。0.414rr+++++r+/r-与配位数配位多面体的极限半径比配位多面体配位数半径比(r+/r-)min晶体构型平面三角形30.155四面体40.225八面体60.414立方体80.732立方八面体121.000科学探究:影响离子晶体中离子配位数的因素配位数468半径比0.2~0.40.4~0.70.7~1.0空间构型ZnSNaClCsCl决定离子晶体结构的因素几何因素晶体中正负离子的半径比电荷因素晶体中正负离子的电荷比键性因素离子键的纯粹因素CaF2的晶胞阴阳离子的配位数分别是多少?二、晶格能定义:气态离子形成1摩离子晶体时释放的能量。晶格能的大小与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。晶格能越大:形成的离子晶体越稳定;(离子键越强)熔点越高;硬度越大。rqq21晶格能仔细阅读仔细阅读表3—8,分析,分析晶格能的大小与离子晶晶格能的大...