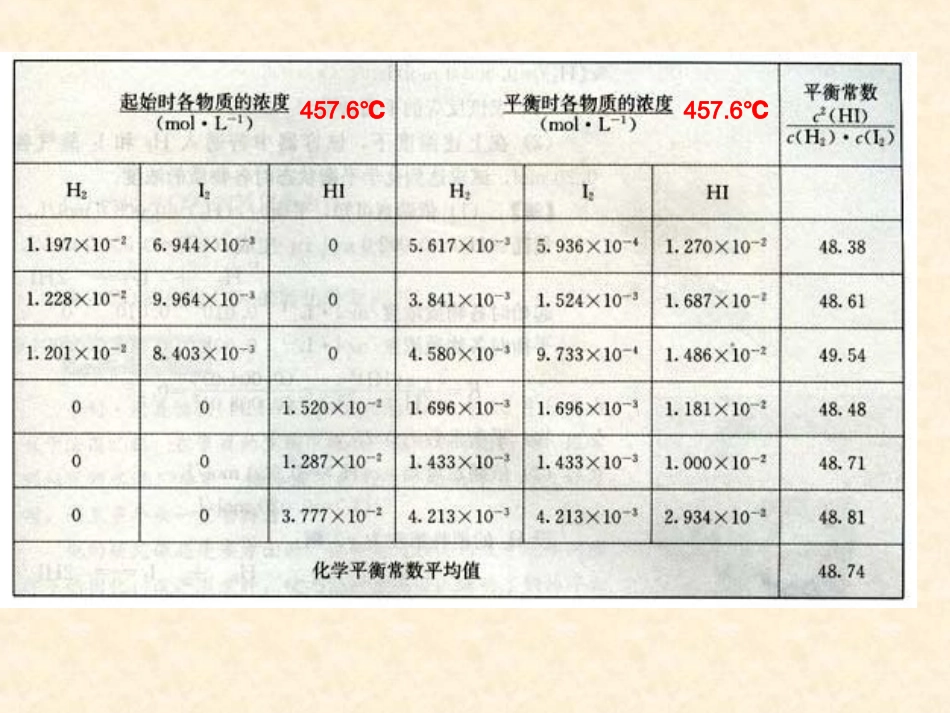
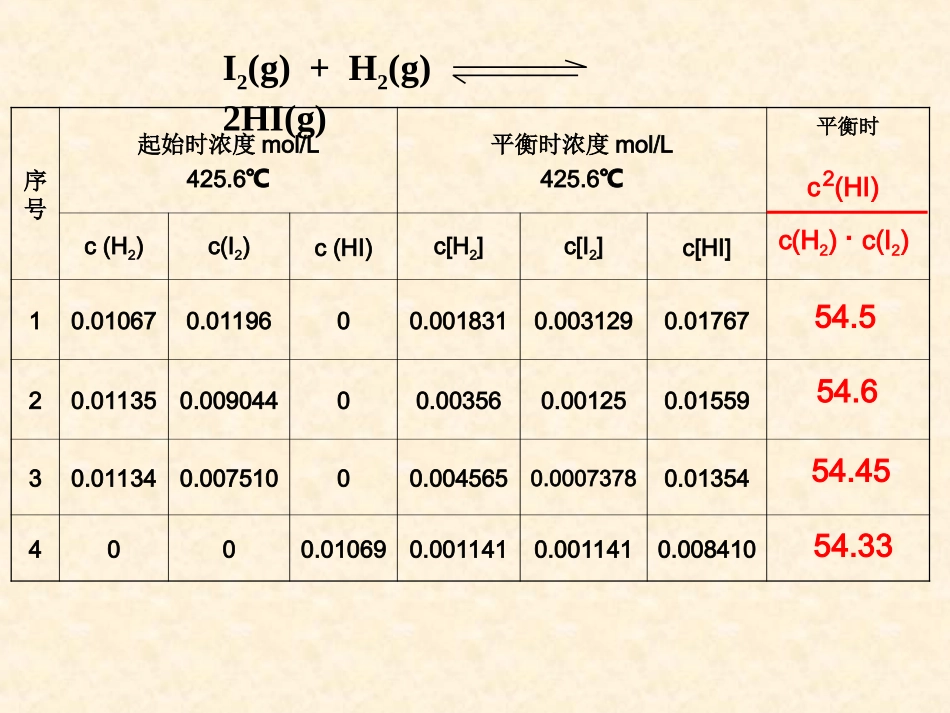
第三节化学平衡第二章化学反应速率与化学平衡化学平衡常数457.6℃457.6℃序号起始时浓度mol/L425.6℃平衡时浓度mol/L425.6℃平衡时c(H2)c(I2)c(HI)c[H2]c[I2]c[HI]10.010670.0119600.0018310.0031290.0176720.011350.00904400.003560.001250.0155930.011340.00751000.0045650.00073780.013544000.010690.0011410.0011410.008410I2(g)+H2(g)2HI(g)54.554.654.4554.33c(HI)2c(H2)·c(I2)通过分析实验数据得出:1、一定温度下,为常数用K表示;)()()(222IcHcHIc实际上,人们发现对其它平衡体系的数据进行分析,都有类似的关系。2、常数K与反应的起始浓度大小无关;3、温度发生变化,K值也发生变化一、定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂(以其化学计量数为幂)之积与反应物浓度幂之积的比值是个常数,这个常数就是该反应的化学平衡常数(简称平衡常数)数学表达式:在某温度时,对于一般的可逆反应mA(g)+nB(g)pC(g)+qD(g)cp(C)·cq(D)cm(A)·cn(B)K=)()()(22232OcSOcSOcK)()()(22OHcHcCOcK练习:试写出下列反应在某温度时的平衡常数表达式:2SO2(g)+O2(g)2SO3(g)C(s)+H2O(g)CO(g)+H2(g)催化剂二.书写平衡常数表达式的规则c(CO)K=c(CO2)·c(H2)1)在反应中出现的固体和纯液体,它们的浓度不写在平衡常数表达式中。平衡常数表达式中只包括气态物质和溶液中各溶质的浓度。c(CO2)K=CaCO3(s)CaO(s)+CO2(g)CO2(g)+H2(g)CO(g)+H2O(l)2)稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中。Cr2O72-+H2O2CrO42-+2H+K=c2(CrO42-)·c2(H+)c(Cr2O72-)3)同一化学反应,可以用不同的方程式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。K1K2,K1=K22N2(g)+3H2(g)2NH3(g)K11/2N2(g)+3/2H2(g)NH3(g)K2(1)平衡常数K与温度有关,与浓度无关。由K随温度的变化可推断正反应是吸热反应还是放热反应。三.引入平衡常数K的意义例如:不同温度时,反应:H2(g)+I2(g)2HI(g),的浓度平衡常数与温度的关系如下:△温度623K698K763K平衡常数66.954.445.9通过改变温度,平衡常数大小的变化趋势可以判断该可逆反应的正方向是放热反应.若升高温度,K增大,则正反应是_______反应若升高温度,K减小,则正反应是_______反应吸热放热(2)平衡常数K值的大小,可推断反应进行的程度。一般来说,反应的平衡常数K≥105,认为正反应进行得较完全;K≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。K值越大,表示反应进行的程度越大,反应物的转化率越大;K值越小,表示反应进行的程度越小,反应物的转化率越小。三.引入平衡常数K的意义(3)某可逆反应,在一定温度下的任意时刻,生成物的浓度幂乘积与反应物的浓度幂乘积之比称为浓度商,用Q表示。对于可逆反应:mA(g)+nB(g)pC(g)+qD(g)三.引入平衡常数K的意义(1)Q<K,反应_______________(2)Q=K,反应_______________(3)Q>K,反应_______________向正反应方向移动向正反应方向移动不移动不移动向逆反应方向移动向逆反应方向移动可与K比较大小判断在该温度下该时刻反应是否达平衡pqmncCcDcAcBQ=Q=Ⅰ.利用平衡常数,求平衡时各组分的浓度例1.在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L.(1)求反应的平衡常数.(2)在上述温度下,将H2和I2各0.20mol的气态混合物充入该密闭容器中,试求达到平衡时各物质的浓度.四.平衡常数的有关计算Ⅱ.利用平衡常数,求平衡时反应物的转化率例2.在密闭容器中,将2.0molCO和10molH2O混合加热到800ºC,达到下列平衡:K=1.0求CO转化为CO2的转化率。思考:如果将H2O改为15mol,CO的转化率将变为多少?水的转化率呢?