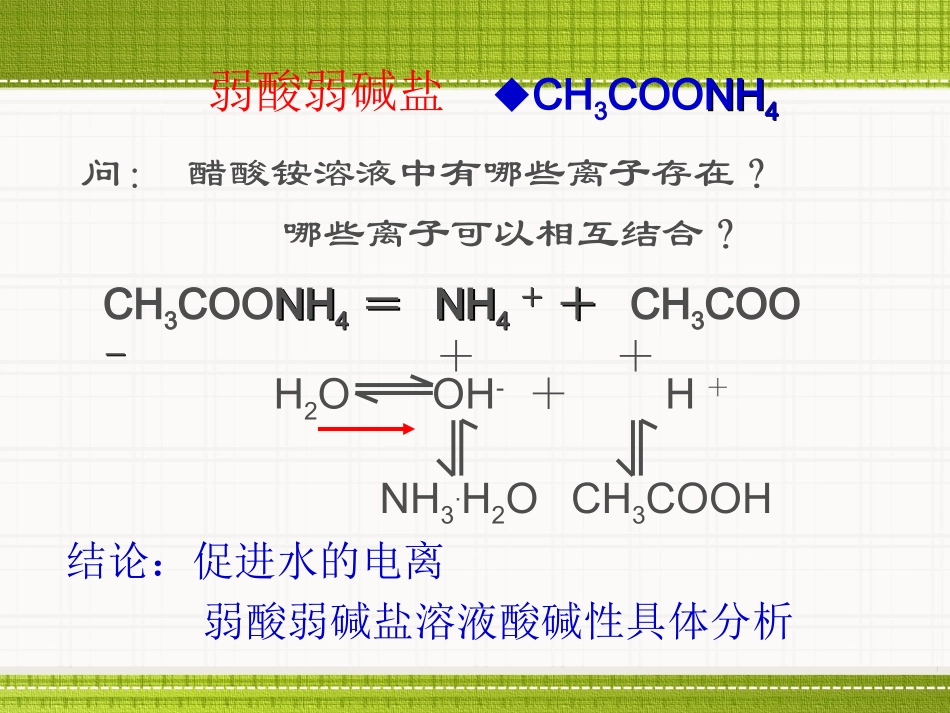
NaCl、KNOKNO33、、NH4Cl、AlAl22(SO(SO44))33、、CH3COONa、Na2CO3、CH3COONHNH44预测溶液的酸碱性,CH3COONHNH44结论:促进水的电离弱酸弱碱盐溶液酸碱性具体分析问:醋酸铵溶液中有哪些离子存在?哪些离子可以相互结合?弱酸弱碱盐CH3COONHNH44==NHNH44++++CH3COO--H2OOH-+H++CH3COOH+NH3.H2O⑴常见弱酸阴离子:CH3COO-、CO32-、F-、S2-等⑵常见弱碱阳离子:NH4+、Al3+、Cu2+、Fe3+、Ag+等1、一般模式:(二)水解方程式的书写(二)水解方程式的书写(1)用化学方程式表示:用化学方程式表示:盐+水酸+碱(2)用离子方程式表示:盐的弱离子+水弱酸(或弱碱)+OH-(或H+)(二)水解方程式的书写(二)水解方程式的书写NH4Cl+H2ONH3·H2O+HClNH4++H2ONH3·H2O+H+CH3COONa+H2OCH3COOH+NaOHCH3COO-+H2OCH3COOH+OH-(1)一元弱碱强酸盐:如NH4Cl(2)一元弱酸强碱盐:如CH3COONa水解方程式注意事项:(1)谁弱写谁。(2)一般水解程度小,用可逆号连接,通常不标“↓”“↑”符号,生成物如(H22CO33、NHNH33..HH22OO)也不写成分解产物。(3)多元弱酸的酸根离子分步水解,多元弱碱阳离子一步到位2、不同类型盐的水解方程式的书写:(1)多元弱酸强碱的正盐:如Na2CO3(2)多元弱碱强酸盐:如AlCl3(3)多元弱酸的酸式强碱盐:如NaHCO3、(4)弱酸弱碱碱盐:CH3COONH4CO32-+H2OHCO3-+OH—HCO3--+H2OH2CO3+OH—1、写出NH4Cl、Al2(SO4)3、NaF、的水解离子方程式。NH4++H2ONHNH33..HH22OO+H+F-+H2OHF+OH—Al3++3H2OAl(OH)3+3H+练习:2、判断下列盐溶液的酸碱性,若能水解的写出水解反应的离子方程式。KHCO3NH4NO3K2SFeCl3Na3PO4HCO3-+H2OH2CO3+OH—NH4++H2ONHNH33..HH22OO+H+S2-+H2OHS—+OH—Fe3++3H2OFe(OH)3+3H+磷酸钠溶于水,发生水解实质上是磷酸根离子发生水解.PO43-+H2O=HPO42-+OH-一级水解HPO42-+H2O=H2PO4-+OH-二级水解H2PO4-+H2O=H3PO4+OH-三级水解注:、三步均为可逆,不可合并2、二级水解比一级水解困难的多,三级水解就更加困难了.