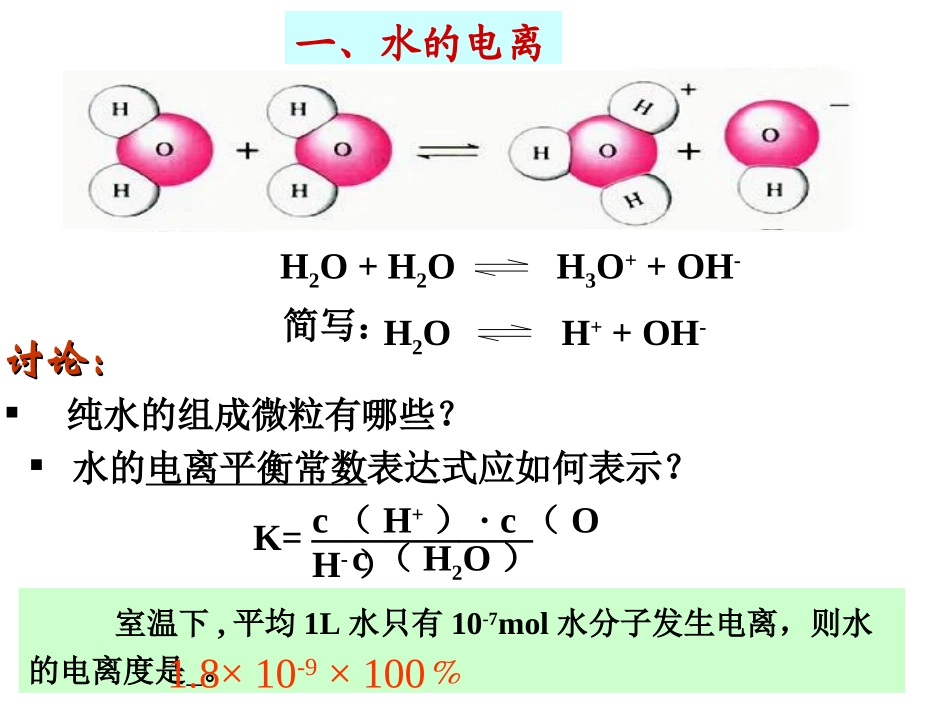
第二节水的电离和溶液的酸碱性()Ⅰ思考:纯水中有离子吗?一、水的电离H2O+H2OH3O++OH-讨论:讨论:纯水的组成微粒有哪些?水的电离平衡常数表达式应如何表示?K=——————c(H+)·c(OH-)c(H2O)H2OH++OH-简写:室温下,平均1L水只有10-7mol水分子发生电离,则水的电离度是。1.8×10-9×100﹪一、水的电离实验证明,水是一种极弱的电解质,能微弱电离。(通常的电流表无法检验其中离子)在25℃,纯水中c(H+)=c(OH-)=1×10-7mol/L∵1L水(55.6mol)中只有10-7mol水电离,K的表达式中的c(H2O)可视为常数。∴平衡常数表达式可以进一步简化为:Kw=c(H+).c(OH-)KW叫做水的离子积常数,简称水的离子积。二、水的离子积常数Kw=c(H+).c(OH—)1、表达式:2、KW的大小KW只是温度的函数,温度升高,KW值增大(与浓度无关);常温指25℃(以后题目若非特别指出即视为常温)。KW25℃=1×10-14;KW100℃=1×10-12练习1、(2007,黄冈中学模拟)下列说法正确的是()A、HCl溶液中无OH-B、NaOH溶液中无H+C、KCl溶液中既无H+也无OH-D、常温下,任何物质的水溶液中都有H+和OH-,且Kw=110-14mol/LD3、影响水电离的因素:温度、外加物质如酸、碱、盐。根据H2OH++OH-和下列条件的改变,填空:升高30℃加NaCl加入NaOH加入HClKwC(OH-)变化C(H+)变化水的电离平衡移动方向改变条件←↑↓—←↓↑—————→↑↑↑在一定温度下,在水中加入酸、碱、盐可能会影响水的电离平衡,但不影响水的离子积。即25℃时:KW=c(H+)·c(OH-)=1×10-14在水中投入醋酸钠,对水的电离平衡有无影响?D练习2、水的电离为H2OH++OH-,已知KW35℃=2.1×10-14。则下列叙述正确的是:A、c(H+)升高时,c(OH-)一定降低B、在35℃时,纯水中c(H+)>c(OH-)C、条件改变,c(H+).c(OH-)之积不变D、水的电离是一个吸热过程3、判断正误:任何水溶液中都存在水的电离平衡。任何水溶液中,都存在Kw=10-14。某温度下,某液体c(H+)=10-7mol/L,则该溶液一定是纯水。4、25℃:A、B、C三种溶液,其中:A中c(H+)=10-3mol/LB中c(OH-)=510-7mol/LC中c(H+)/c(OH-)=106,则三种溶液的c(H+)由大到小顺序:课本P52:第一题A>C>B思考讨论1、0.01mol/L盐酸溶液中,c(H+)、c(OH-)是多少?由水电离出的c(H+)H2O是多少?2、0.01mol/LNaOH溶液中,c(OH-)、c(H+)是多少?由水电离出的c(H+)H2O和c(OH-)H2O分别是多少?利用Kw的计算c(H+)、c(OH-)、c(H+)H2O、c(OH-)H2O无论何种温度,无论酸、中、碱性溶液,都存在水所电离出的H+、OH-,并且由水电离出的这两种离子浓度一定相等作业•金版P47•基础梳理一•思考讨论1、2•自测自评1、2、3、4、6、7、84、浓度均为0.1mol/L的下列溶液中由水电离出的c(H+)大小关系为:①盐酸②醋酸溶液③硫酸溶液④氢氧化钠溶液5、0.1mol/L的HCl溶液20mL,与0.05mol/LBa(OH)2溶液30mL混合后,c(H+)、c(OH-)分别为多少?