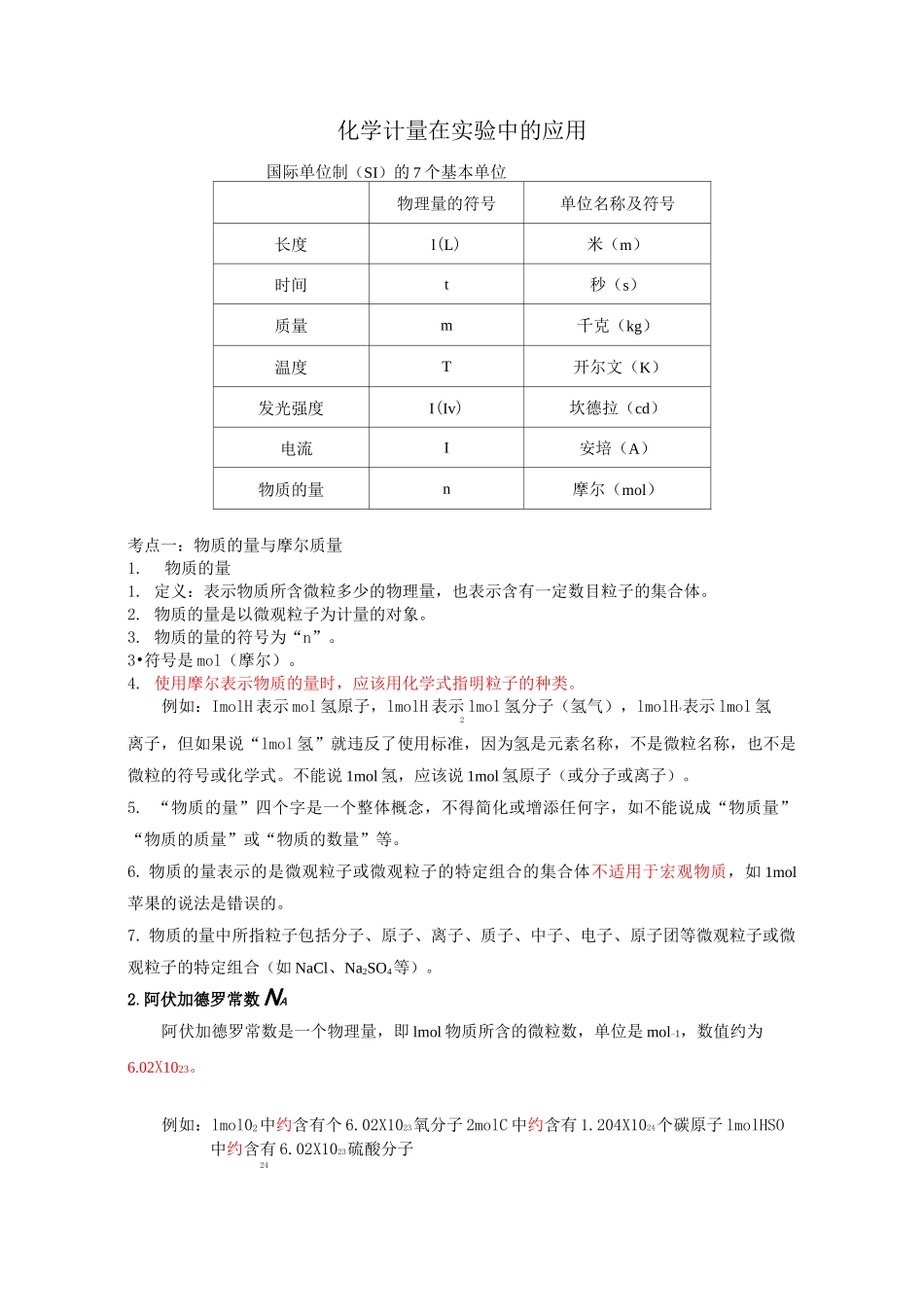
化学计量在实验中的应用国际单位制(SI)的7个基本单位物理量的符号单位名称及符号长度l(L)米(m)时间t秒(s)质量m千克(kg)温度T开尔文(K)发光强度I(Iv)坎德拉(cd)电流I安培(A)物质的量n摩尔(mol)考点一:物质的量与摩尔质量1.物质的量1.定义:表示物质所含微粒多少的物理量,也表示含有一定数目粒子的集合体。2.物质的量是以微观粒子为计量的对象。3.物质的量的符号为“n”。3•符号是mol(摩尔)。4.使用摩尔表示物质的量时,应该用化学式指明粒子的种类。例如:ImolH表示mol氢原子,lmolH表示lmol氢分子(氢气),lmolH+表示lmol氢2离子,但如果说“lmol氢”就违反了使用标准,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。不能说1mol氢,应该说1mol氢原子(或分子或离子)。5.“物质的量”四个字是一个整体概念,不得简化或增添任何字,如不能说成“物质量”“物质的质量”或“物质的数量”等。6.物质的量表示的是微观粒子或微观粒子的特定组合的集合体不适用于宏观物质,如1mol苹果的说法是错误的。7.物质的量中所指粒子包括分子、原子、离子、质子、中子、电子、原子团等微观粒子或微观粒子的特定组合(如NaCl、Na2SO4等)。2.阿伏加德罗常数NA阿伏加德罗常数是一个物理量,即lmol物质所含的微粒数,单位是mol-1,数值约为6.02X1023。例如:lmol02中约含有个6.02X1023氧分子2molC中约含有1.204X1024个碳原子lmolHSO中约含有6.02X1023硫酸分子241.5molNaOH中约含有9.03X1023个Na+和9.03X1023个0H-;nmol某微粒集合体中所含微粒数约为nX6.02X1023。如果用n表示物质的量,N表示阿伏伽德罗常数,表示微粒数,三者之间的关系是:N=n^N,AA由此可以推知n=N/NA3.摩尔质量1.定义:单位物质的量的物质所具有的质量①单位是g/mol或kg/mol②摩尔质量以g/mol为单位时,在数值上等于其相对分子质量或相对原子质量③计算公式:n=m/M4.气体的摩尔体积①.定义:单位物质的量的气体所占的体积,符号Vm。(提问:为什么液体、固体没有摩尔体积)②计算公式:n=V/Vm(标准状况下:Vm=22.4L/mol)*注意点:摩尔质量与相对原子质量、相对分子质量的区别与联系摩尔质量(M)相对原子质量相对分子质量概念①单位物质的量的物质所具有的质量;②单位是g/mol或kg/mol①一个原子的质量与12C的1/12作比较,所得的比值;②单位:无①化学式中各兀素相对原子质量之和;②单位:无单位联系摩尔质量以g/mol为单位时,在数值上等于其相对分子质量或相对原子质量;混合物组成一定时,1mol混合物的质量在数值上就是该混合物的摩尔质量,在数值上等于该混合物的平均相对分子质量特别提醒①1mol任何粒子的质量以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。5.物质的量"、质量加、粒子数目N之间的关系计算关系式(公式)主要应用注意事项Nr在n、N和NA中,已知任意两项求第三项①NA有单位:mol-1②求n或N时,概念性问题用NA;数字性问题用6.02X1023mol-1mM=~n①在M、n和m中,已知任意两项求第三项②先求M,后求MrM的单位取g/mol时,m的单位取g;M的单位取kg/mol时,m的单位取kg-MmnXMXNAN-NA①在m、NA、M和N中,已知任意三项求第四项②以n恒等列代数方程式解决较复①重视n在m和N之间的桥梁作用②与N有关的问题莫忽视微杂的问题粒的组成和种类质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系MxxNA质量匚物质的量芒粒子数(m)-M(n)NA-(N)难点一:气体的摩尔体积1.气体摩尔体积的适用范围气体摩尔体积的适用范围是气态物质,可以是单一气体,也可以是混合气体,如0.2molH2与0.8molO2的混合气体在标准状况下的体积约为22.4L。2.气体摩尔体积的数值(1)气体摩尔体积的数值与温度和压强有关(2)标准状况下任何气体的气体摩尔体积为22.4L・mo卜1(3)非标准状况下气体摩尔体积可能是22.4L・mo卜1,也可能不是22.4L・mo卜1。1mol气体的体积若为22.4L,它所处的状况不一定是标准状况,如气体在273°C和202kPa时,V为22.4L・mol-1。m特别提醒利用22.4L・mo卜1计算或判断时一定要看清气体所处的状况。常出现的错误:①忽视物质在标准状况下的状态是否为气态,如水在标准状...