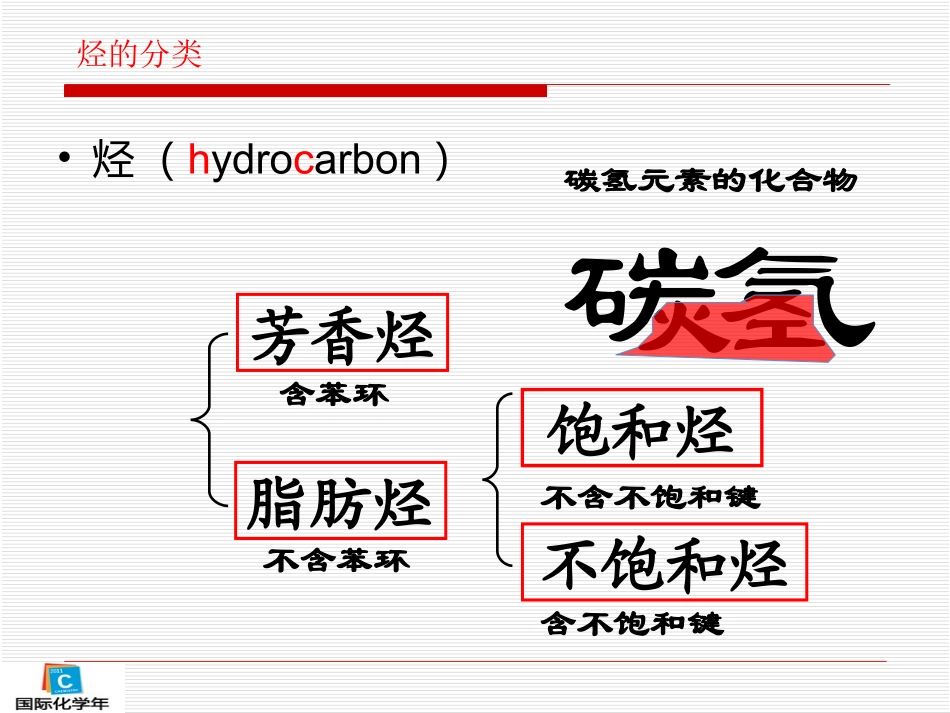
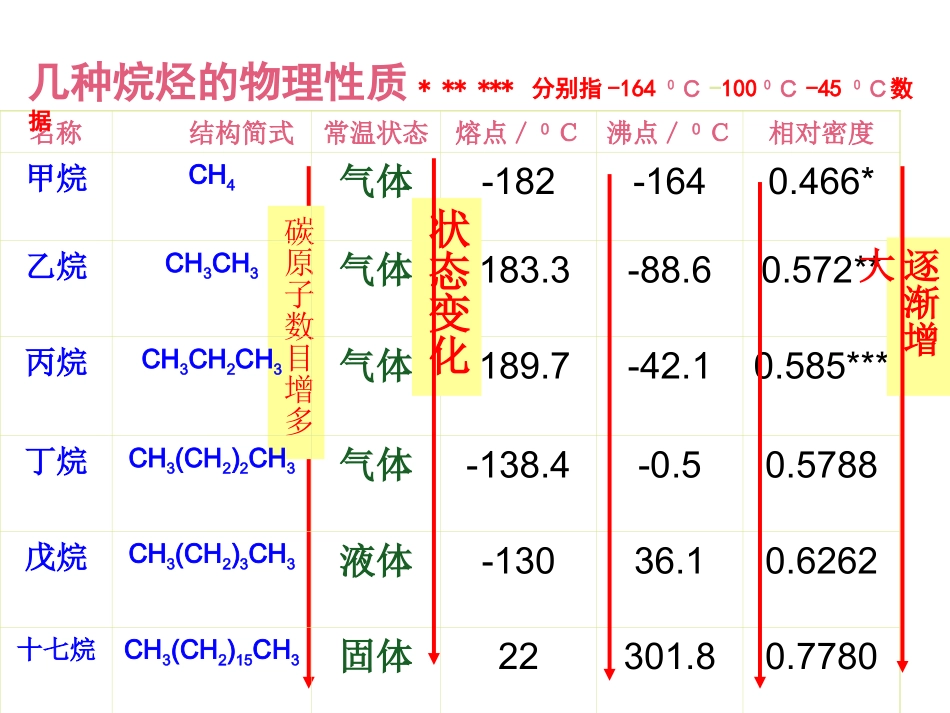
脂肪烃烃的分类•烃(hydrocarbon)饱和烃碳氢不含苯环含苯环不含不饱和键含不饱和键不饱和烃芳香烃碳氢元素的化合物脂肪烃碳原子数目增多名称结构简式常温状态熔点/0C沸点/0C相对密度甲烷CH4气体-182-1640.466*乙烷CH3CH3气体-183.3-88.60.572**丙烷CH3CH2CH3气体-189.7-42.10.585***丁烷CH3(CH2)2CH3气体-138.4-0.50.5788戊烷CH3(CH2)3CH3液体-13036.10.6262十七烷CH3(CH2)15CH3固体22301.80.7780几种烷烃的物理性质******分别指-1640C-1000C-450C数据状态变化逐渐增大同碳原子数的烷烃,支链越多熔沸点越低。直链烷烃的熔点和沸点24681012141618分子中的碳原子数0-150-100-50050100150200熔点常温沸点一、脂肪烃的物理性质分子中碳原子数直链烷烃的相对密度2468101214160.60.40.20随着分子中碳原子数的递增,烷烃同系物的熔点、沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态。结论:在常温常压下,脂肪烃分子中C4以下的烃为气态,C5C15之间的一般为液态,C16以上的烃一般是固体。脂肪烃的密度都比水小,且难溶于水,易溶于有机溶剂。烷烃同系物随着分子中碳原子数的递增,熔点、沸点逐渐升高,相对密度也逐渐增大。烯烃、炔烃及其同系物的熔点和沸点一般也随着其分子中碳原子数的递增而呈现上升的趋势。一、脂肪烃的物理性质脂肪烃都是分子晶体,随着分子中碳原子数的递增,相对分子质量的增大,分子间作用力而逐渐增大,从而导致物理性质上的递变1、下列烷烃沸点最高的是()A.CH3CH2CH3B.CH3CH2CH2CH3C.CH3(CH2)3CH3D.(CH3)2CHCH2CH32、下列混合物可以用分液的方法分离的是()A.苯和溴苯B.汽油和辛烷C.己烷和水D.戊烷和庚烷练习:CC1834年9月30日,卡尔·肖莱马诞生于德国黑森林洲达姆斯塔德城的一个手工业工人家庭。1859年,他靠自己谋生所积蓄的钱,考上了著名化学家李比希主持的吉森大学化学系。在1862~1864年三年里,肖莱马做了大量的实验,发现了一条被称为CnH2n+2系列碳氢化合物的沸点定律。那么这个定律,现在就反应在直链烷烃的沸点和熔点上。二、脂肪烃的结构烃的类型通式实例结构简式结构特点烷烃烯烃炔烃二烯烃CnH2n+2CnH2nCnH2n-2C2H6C2H4C2H2CH3-CH3CH2=CH2CH≡CHC-CC=CC≡CCnH2n-2C4H6(丁二烯)CH2=CH-CH=CH2C=C-C=C烷烃的分子结构一、烷烃1、结构特点:单键、链状、饱和2、组成通式:CnH2n+2(n≥1)一)烷烃烷烃的化学性质:通常情况下,性质比较稳定,与强酸、强碱和强氧化剂等一般不发生化学反应。(1)氧化反应CH4+2O2CO2+2H2O点燃甲烷在空气中的体积分数为5%~15.4%时,点燃会爆炸。点燃前必须验纯!一、烷烃(2)取代反应一氯甲烷(气体)有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫做取代反应。取代反应:脂肪烃的化学性质取代反应常见类型:卤代反应、酯化反应、硝化反应等练习:1、写出乙烷(CH3CH3)与氯气(Cl2)发生二氯取代反应的产物结构式。2、写出C5H12的一氯代物的所有同分异构体的结构简式。H-C-C-HHHClClH-C-C-HHHClCl一、烷烃(3)裂化反应(分解反应)CH4C+2H2高温22233223223332232343223HCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCHCH三、烯烃烯烃的结构二)烯烃电子式、结构式、结构简式书写注意事项:正:CH2=CH2H2C=CH2误:CH2CH2CCHHHHH︰C︰︰C︰H‥‥HH二)烯烃1、结构特点:双键、链状、不饱和2、组成通式:CnH2n(n≥2)二)烯烃3、化学性质:(1)氧化反应①燃烧:CH2=CH2+3O22CO2+2H2O点燃明亮火焰,少量黑烟②使酸性高锰酸钾溶液褪色(被氧化)可鉴别乙烯与甲烷等饱和气态烷烃5CH2=CH2+12KMnO4+18H2SO410CO2↑+12MnSO4+6K2SO4+28H2O二)烯烃(2)加成反应乙烯可使溴水或溴的四氯化碳溶液颜色褪色CH2=CH2+Br-Br→CH2Br-CH2Br1,2-二溴乙烷二)烯烃有机物分子中双键或叁键两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应。有机物分子中双键或叁键两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应。CH2=CH2+HClCH3CH2Cl催化剂CH2=CH2+H2催化剂CH3CH3CH2=CH2+H2O催化剂高温高压CH3CH2OH练习:...