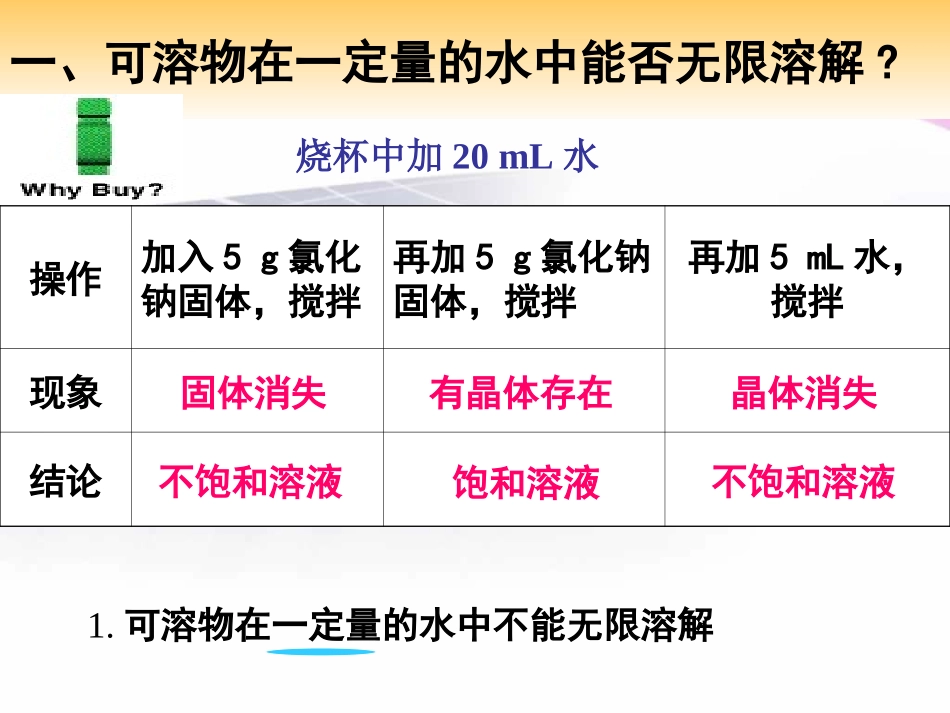
人教版化学九年级下册•第九单元溶液•课题2溶解度•(第一课时)一、可溶物在一定量的水中能否无限溶解?操作加入5g氯化钠固体,搅拌再加5g氯化钠固体,搅拌再加5mL水,搅拌现象结论烧杯中加20mL水固体消失有晶体存在晶体消失不饱和溶液饱和溶液不饱和溶液1.可溶物在一定量的水中不能无限溶解2.用硝酸钾代替氯化钠进行下面实验操作现象结论加入5g硝酸钾,搅拌再加5g硝酸钾,搅拌……加热再加5g硝酸钾,搅拌冷却物质在一定量溶剂中溶解的量与温度有关固体溶解有剩余固体有剩余固体固体继续溶解固体继续溶解有晶体析出二、溶液的分类:饱和溶液和不饱和溶液饱和溶液在一定温度、一定量的溶剂中,溶质不能无限溶解的溶液;1.饱和溶液的前提条件是什么?2.在上面的前提条件下,关键看什么?3.为什么必须说明是“这种溶质”的饱和溶液?一定温度、一定量的溶剂。溶质是否能继续溶解。在一定温度、一定量的溶剂中,溶质可以继续溶解的溶液.不饱和溶液三、判断溶液是否饱和的方法•从概念来看是判断一定条件下溶液是否还能继续溶解。从外观上看如果溶液底部存在未溶完的物质,说明溶液在此温度下,不能再溶解该物质,肯定是饱和溶液;如果溶液中不存在未溶解的固体,那么所得的溶液可能是饱和溶液。随堂练习:1.把20g硝酸钾溶解在100g水中得到的溶液是饱和溶液。2.在20℃时把40g氯化钠溶解在100g水中得到136g溶液,此时得到的溶液是20℃硝酸钾的饱和溶液。3.在一定温度下,向一定量的氯化钠饱和溶液中加入3g硝酸钾,同时析出3g氯化钠晶体。动动手1.10毫升水+2克食盐:振荡,现象:溶液类型:2.10毫升水+0.2克熟石灰:振荡,现象:溶液类型:食盐溶解食盐的不饱和溶液熟石灰不完全溶解熟石灰的饱和溶液浓度大浓度小[总结一]浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。[总结二]同一物质,相同温度,饱和溶液比不饱和溶液要浓。[练习]在一定温度下,某物质的饱和溶液一定是:1)非常浓的溶液;2)增加该溶质,能继续溶解的溶液;3)非常稀的溶液;4)增加该溶质,不能继续溶解的溶液。四、浓稀溶液与饱和溶液的关系如何使溶液底部的溶质晶体溶解呢?再加水,能使固体都溶解吗?加水和加热后所得溶液是否饱和?如何证明?在溶液中再加入该溶质,看是否能溶?浓溶液稀溶液加溶剂加溶质;蒸发溶剂饱和溶液不饱和溶液加溶剂升温加溶质;蒸发溶剂降温在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是:1)降低溶液温度;2)加入溶质硝酸钾;3)升高溶液的温度;4)蒸发溶液中的溶剂。五、溶液的相互转化讨论1.在一定温度下,某物质的饱和溶液一定是A.很浓的溶液B.很稀的溶液C.不能继续溶解该物质的溶液D.不能溶解任何物质的溶液.2.某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是A.溶质质量减少B.溶液质量增大C.固体质量不变D.溶质质量增加3.一定温度下,从500克的饱和溶液中倒出100克溶液,剩余的溶液里,下列数值比原溶液减少的是①溶质的质量②溶剂的质量③溶液的密度④溶液的质量⑤溶质的质量分数(即:浓度)A.①②③④B.②③④⑤C.①②④D.①②③④⑤讨论4.20℃时,100克硝酸钾饱和溶液,当其他条件不变,温度升高到80℃时,该溶液为溶液(饱和溶液还是不饱和溶液),此时溶液的质量为克。不饱和溶液100结晶:•溶质在溶液中过剩以晶体形式析出,这一过程叫结晶。•降低温度析出晶体叫降温结晶或冷却热饱和溶液结晶。•蒸发溶剂析出晶体叫蒸发结晶。[课堂小结]1.饱和溶液和不饱和溶液的定义、区别、判断方法和相互转化。2.饱和溶液和浓溶液,不饱和溶液与稀溶液的关系。饱和溶液不饱和溶液加溶剂升温加溶质;蒸发溶剂降温3.结晶1.为什么汗水带咸味?被汗水浸湿的衣服晾干后,为什么常出现白色的斑痕?2.有一瓶蒸馏水和一瓶稀氯化钾溶液,用什么简单的方法把它们区分开?讨论人分泌的汗水,是氯化钠溶液。因为溶有氯化钠,所以带咸味。凉干,是将水分蒸发,所以有氯化钠析出。蒸发通电