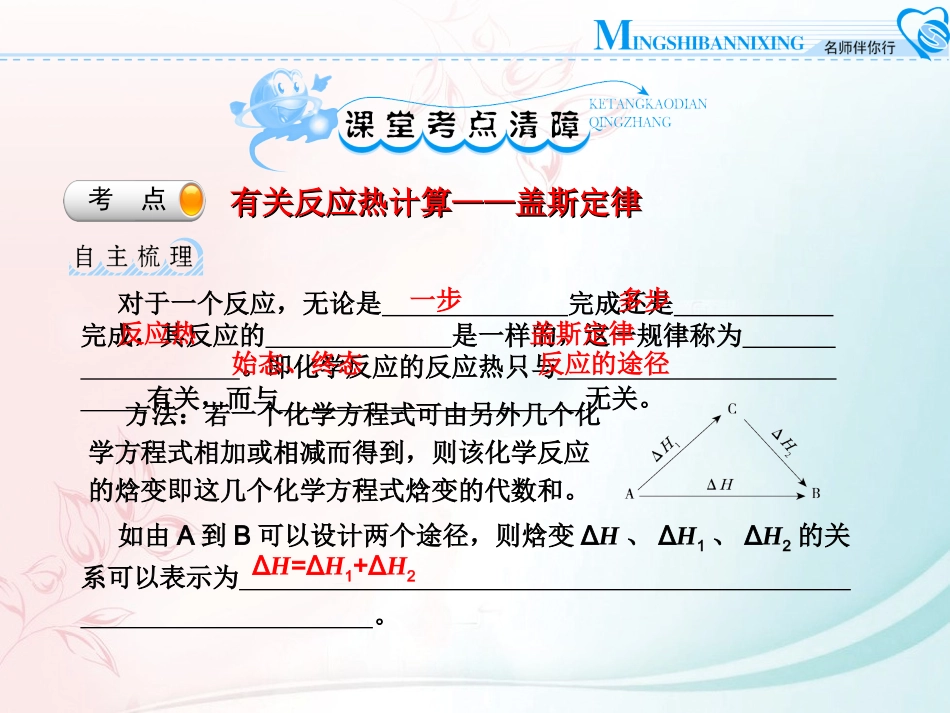
开始学案2反应热的计算与应用考点有关反应热计算——盖斯定律有关反应热计算——盖斯定律对于一个反应,无论是完成还是完成,其反应的是一样的,这一规律称为。即化学反应的反应热只与有关,而与无关。方法:若一个化学方程式可由另外几个化学方程式相加或相减而得到,则该化学反应的焓变即这几个化学方程式焓变的代数和。如由A到B可以设计两个途径,则焓变ΔH、ΔH1、ΔH2的关系可以表示为。ΔH=ΔH1+ΔH2一步多步反应热盖斯定律始态、终态反应的途径在298K、100kPa时,已知:2H2O(g)==O2(g)+2H2(g)ΔH1Cl2(g)+H2(g)==2HCl(g)ΔH22Cl2(g)+2H2O(g)==4HCl(g)+O2(g)ΔH3则ΔH3与ΔH1和ΔH2间的关系正确的是()A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH2A1.盖斯定律的应用盖斯定律在科学研究中具有重要意义。因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。例如:C(s)+1/2O2(g)==CO(g)上述反应在O2供应充分时,可燃烧生成CO2、O2,供应不充分时,虽可生成CO,但同时还部分生成CO2。因此该反应的ΔH无法直接测得。但是下述两个反应的ΔH却可以直接测得:C(s)+O2(g)==CO2(g)ΔH1=-393.5kJ/mol,CO(g)+1/2O2(g)==CO2(g)ΔH2=-283.0kJ/mol。根据盖斯定律,就可以计算出欲求反应的ΔH。分析上述反应的关系,即知ΔH1=ΔH2+ΔH3ΔH3=ΔH1-ΔH2=-393.5kJ/mol-(-283.0kJ/mol)=-110.5kJ/mol。2.反应热计算根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。(1)反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。(2)关于热化学方程式的简单计算的依据①热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。②热化学方程式之间可以进行加减运算。【例】已知①2C(s)+O2(g)==2CO(g)ΔH=-221.0kJ·mol-1②2H2(g)+O2(g)==2H2O(g)ΔH=-483.6kJ·mol-1则反应C(s)+H2O(g)==CO(g)+H2(g)的ΔH为()A.+131.3kJ·mol-1B.-131.3kJ·mol-1C.-352.3kJ·mol-1D.+262.6kJ·mol-1【解析】由②H2O(g)==H2(g)+1/2O2(g)ΔH=+241.8kJ·mol-1则由①C(s)+1/2O2(g)==CO(g)ΔH=-110.5kJ·mol-1,C(s)+H2O(g)==CO(g)+H2(g)ΔH=(241.8-110.5)kJ·mol-1=+131.3kJ·mol-1。【解析】由②H2O(g)==H2(g)+1/2O2(g)ΔH=+241.8kJ·mol-1则由①C(s)+1/2O2(g)==CO(g)ΔH=-110.5kJ·mol-1,C(s)+H2O(g)==CO(g)+H2(g)ΔH=(241.8-110.5)kJ·mol-1=+131.3kJ·mol-1。【答案】A观察图a和图b,根据盖斯定律,写出ΔH1、ΔH2、ΔH3、ΔH4、ΔH5和ΔH6的关系。图a:;图b:。ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0ΔH6=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5•一样的软件•不一样的感觉•一样的教室•不一样的心情•一样的知识•不一样的收获•