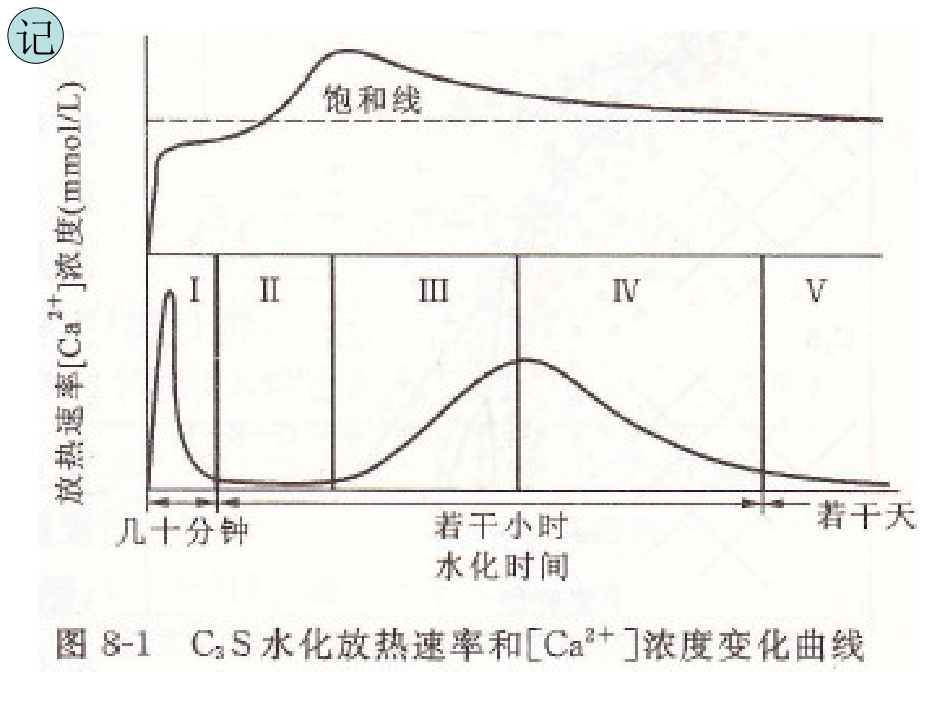
第八章硅酸盐水泥的水化和硬化第一节熟料矿物的水化•一、C3S•C3S在常温下的水化反应,用方程式表示:•3CaO·SiO2+nH2O=xCaO·SiO2·yH2O+(3-x)Ca(OH)2•即C3S+nH=C-S-H+(3-x)CH记•C3S的水化速率很快,其水化过程根据水化放热速率-时间曲线可分为五个阶段:•1.诱导前期:加水后立即发生急剧反应,但该阶段时间很短,在15min以内结束。•2.诱导期(静止期):反应速率极其缓慢,一般持续1~4h,是硅酸盐水泥浆体能在几小时内保持塑性的原因。初凝时间基本上相当于诱导期的结束。•3.加速期:反应重新加快,反应速率随时间而增长,出现第二个放热峰,在达到峰顶时即告结束。此时终凝已过,开始硬化。记•4.减速期:反应速率随时间下降的阶段,约持续12~24h,水化作用逐渐受扩散速率的控制。•5.稳定期:反应速率很低、基本稳定的阶段,水化作用完全受扩散速率控制。•4、5两期合称为扩散控制期。•将诱导前期和诱导期合并称为水化早期,加速期和减速期为水化中期,而稳定期则称为水化后期。•(一)C3S的早期水化•有关诱导期的本质也就是诱导期的开始及结束的原因,存在着不少看法。•①保护膜理论•诱导期是由于水化产物形成了保护膜层。当保护膜破坏时,诱导期就结束。•假设C3S在水中是一致溶,最初生成的水化物C3SHn很快就在C3S周围形成了致密的保护膜层,从而阻碍了C3S的进一步水化,使放热变慢,向液相溶出Ca2+的速率也相应降低,导致诱导期的开始。当第一水化物转变为较易使离子通过的第二水化物(C/S≈0.8~1.5)时,水化重新加速,较多的Ca2+和OH-进入液相达到过饱和,并加快放热,诱导期即告结束。•②晶核形成延缓理论介绍“晶体成核—生长”理论•诱导期是由于氢氧化钙或C-S-H或者它们两者的晶核形成和生长,都需要一定时间,从而使水化延缓所致。•认为C3S最初不一致溶,主要是Ca2+和OH-溶出,液相中的C/S比远高于3,使C3S表面变为缺钙的“富硅层”。然后,Ca2+吸附到富硅的表面,使其带上正电荷,形成双电层,因而C3S溶出Ca2+的速度减慢,导致诱导期的产生。•一直到液相中的Ca2+和OH-缓慢增长,达到足够的过饱和度(饱和度的1.5~2.0倍),才形成稳定的Ca(OH)2晶核。•当生长到相当尺寸,且数量又足够多时,液相中的Ca2+和OH-就迅速沉析出Ca(OH)2晶体,促使C3S加快溶解,水化重又加速。同时,Ca(OH)2还会和硅酸根离子相结合,因而也可作为C-S-H的晶核。•较近的一些研究表明,诱导期更可能是由于C-S-H的成核和生长受到延缓的缘故。•③关于“晶格缺陷”的理论•C3S的早期水化反应并不遍及整个表面,而是在最易与水发生作用的活化点上进行。•非均匀分布的水化产物,就不会形成上述的保护膜层,从而提出晶格缺陷的类别和数量则是决定诱导期长短的主要因素。•④斯卡尔内综合各方观点提出如下见解•当与水接触后在C3S表面有晶格缺陷的部位即活化点上很快发生水解,Ca2+和OH-进入溶液,就在C3S表面形成一个缺钙的“富硅层”。接着,Ca2+吸附到“富硅层”表面形成双电层,从而使C3S溶解受阻而出现诱导期。•另一方面,因双电层所形成的ξ电位,使颗粒在溶液中保持分散状态,一直到ξ电位下降接近于零时,才会产生凝聚。由于C3S仍在缓慢水化,待溶液中Ca(OH)2浓度达到一定的过饱和度时,Ca(OH)2析晶,导致诱导期结束。•与此同时,还会有C-S-H的沉淀析出,因为硅酸根离子比Ca2+较难迁移,所以C—S—H的生长仅限于表面,Ca(OH)2的晶体开始可能也在C3S表面生长,但有些晶体会远离颗粒或在浆体的充水孔隙中形成。•ξ电位:吸附层与扩散层之间的电位差。•当阳离子浓度进一步增加直至扩散层中的阳离子全部压缩至吸附层内时ξ电位等于0。•(二)C3S的中期水化•在C3S水化的加速期内,伴随着Ca(OH)2及C-S-H的形成和长大,液相中Ca(OH)2及C-S-H的过饱和度降低,,又会相应地使Ca(OH)2及C-S-H的生长速度逐渐变慢。随着水化产物在颗粒周围的形成,C3S的水化也受到阻碍。因而,水化加速过程就逐渐转入减速阶段。•最初的产物,大部分生长在颗粒原始周界以外由水所填充的空间,这部分C-S-H称为“外部产物”•后期的生长则在颗粒原始周界以内的区域进行,这部分C-S-H称为“内部产物”。•(三)C3S的后期水...