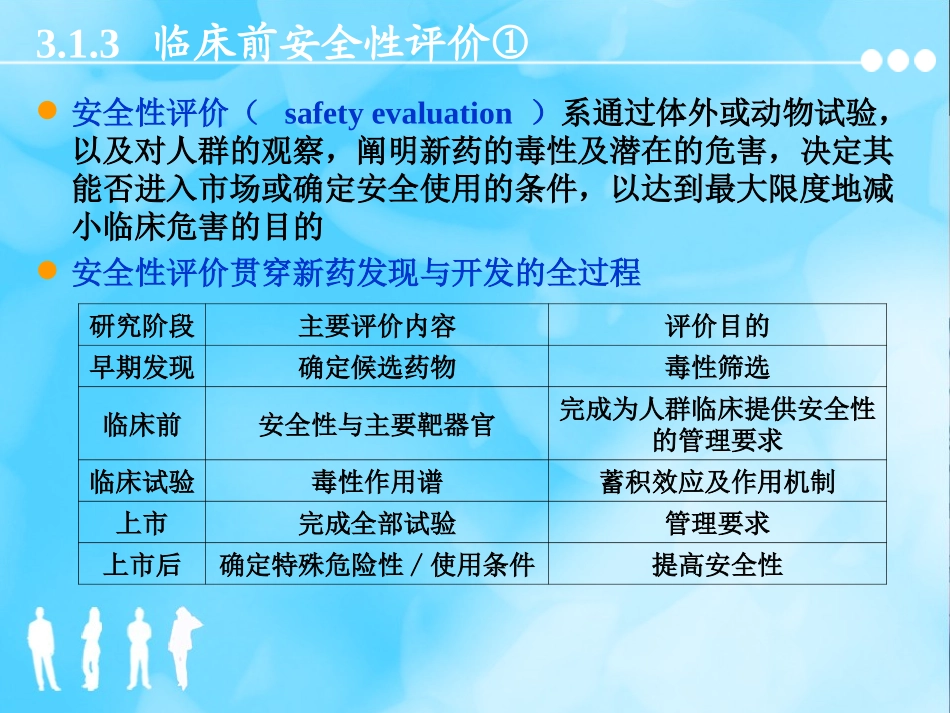
主要内容3.1新药的临床前研究3.2新药的临床试验3.3GLP和GCP3.1.3临床前安全性评价①安全性评价(safetyevaluation)系通过体外或动物试验,以及对人群的观察,阐明新药的毒性及潜在的危害,决定其能否进入市场或确定安全使用的条件,以达到最大限度地减小临床危害的目的安全性评价贯穿新药发现与开发的全过程研究阶段主要评价内容评价目的早期发现确定候选药物毒性筛选临床前安全性与主要靶器官完成为人群临床提供安全性的管理要求临床试验毒性作用谱蓄积效应及作用机制上市完成全部试验管理要求上市后确定特殊危险性/使用条件提高安全性3.1.3临床前安全性评价②临床前安全性评价(即毒理学试验研究)内容:•急性毒性试验——单剂量和/或多剂量短期给药。给药剂量向一定范围增加,以确定试验化合物不产生毒性的最大剂量、发生严重毒性的剂量水平及中等毒性剂量水平•长期毒性试验——用于人体一周或以上的药物,必须要有90-180天的动物试验表明其安全性;若是用于慢性疾病治疗,必须进行一年或更长的动物试验•生殖毒性试验——包括抚养和交配行为、胚胎早期、早产和产后发育、多代影响和致畸性•遗传毒性试验——测定试验化合物是否引起基因突变或引起微粒体或DNA的损伤3.1.3临床前安全性评价②临床前安全性评价(即毒理学试验研究)内容:•致癌试验——当一个化合物具有足够的前景进入人体临床试验时才进行•依赖性试验——分为神经药理学试验、躯体依赖性试验和精神依赖性试验•毒代动力学试验——运用药代动力学的原理和方法,定量地研究毒性剂量下,药物在动物体内的吸收、分布、代谢、排泄过程及特点•刺激性、过敏性和溶血性试验——药物制剂经眼、耳、鼻、口腔、呼吸道、关节腔、皮肤、直肠、阴道、静脉、动脉、肌肉、皮下、静脉旁和鞘内等非口服途径给药,对用药局部产生的毒性(如刺激性和过敏性等)及对全身产生的毒性(如过敏性和溶血性等)3.1.3临床前安全性评价③新药毒理学一般研究流程毒理学评价遗传毒理学急性毒理学亚急性毒理学(14d~90d)慢性毒理学(6m/9m/12m)致癌性试验(2-year)质量研究(ICH)毒代动力学生殖发育毒理学非正规的先导优化试验(急毒或14d毒理试验,代谢,遗传毒性试验)比较代谢研究(体内/体外)安全性药理学主要代谢产物的毒理学环境评估3.1.4新药研究申请新药研究申请(InvestigationalNewDrug,IND):•报送有关资料(研制方法、药理及毒理试验结果、质量指标等)和样品•经SFDA批准、获得《药物临床试验批件》后,才能开始进行临床试验美国的IND流程向FDA提交初始IND申请FDA评审(最长30d)退回申请(需要进一步的资料)申请人提供修订许可申请3.2新药的临床试验临床试验(ClinicalTrial)——任何在人体(病人或健康志愿者)进行的药物系统性研究,以证实试验药物的作用、不良反应及试验药物的吸收、分布、代谢和排泄,确定试验药物的疗效与安全性《药品注册管理办法》附件——分别对中药和天然药物、化学药品、生物制品的临床试验,作出了一些具体规定临床试验包括生物等效性试验——必须遵循GCP和赫尔辛基宣言,并且应由具备药物临床试验资格的机构承担临床试验分期——I、II、III、IV期,在某些特殊情况下,经SFDA批准也可仅进行II期、III期临床试验或仅进行III期临床试验例如:AZT的临床试验只进行了106天,发现能显著增加病人存活率,FDA批准其上市之前用于治疗4000多名艾滋病患者。3.2新药的临床试验新药临床试验的分期试验分期试验人群试验例数试验内容试验目的试验时间Ⅰ期健康志愿者≥20耐受性试验药代动力学安全性为主提供给药方案依据数月Ⅱ期患者≥100(300)多中心试验有效性探索期数月~2年Ⅲ期患者≥300(500)扩大的多中心试验有效性确证期评价利益与风险1~4年Ⅳ期患者≥2000应用研究阶段上市后监测期3~5年注:括号内为预防用生物制品试验例数3.2.1Ⅰ期临床试验3.2.1.1人体耐受性试验3.2.1.2人体药代动力学试验3.2.1.3试验报告的撰写临床试验报告是对药物临床试验过程和结果的总结,可参考相关格式,以满足药品注册申请的要求。3.2.1.1人体耐受性试验①目标——在临床前研究的基础上,根据动物试验...