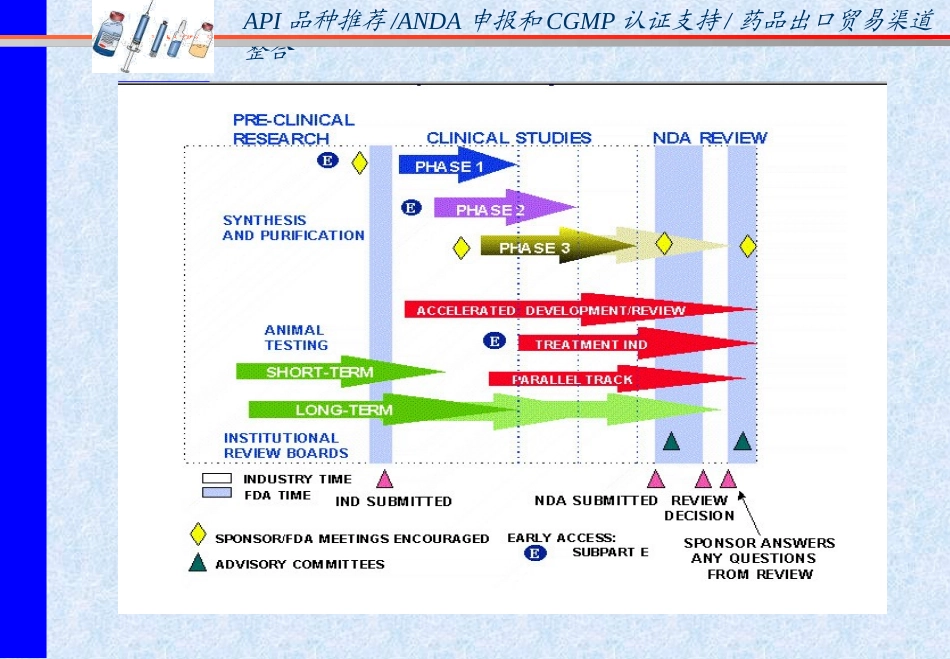
API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合FDADrugApprovalProcessFDA药品批准程序fromChemistryManufacturingControlsPerspective化学生产控制(CMC)展望上海宝钜API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合NewDrugDevelopmentProcess新药的研发过程1.Research&Development(研究和开发)2.Pre-clinicalStudies(药理毒理研究)3.InvestigationalNewDrug(IND)PhaseI,II,IIIClinicalTrials(临床试验)4.NewDrugApplication(NDA)(新药申请)5.Post-marketing(新药批准后的市场调查跟踪)Post-approvalchanges(批准后的生产工艺变更)API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合8API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合NewDrugDevelopmentProcess新药研发程序NewChemicalEntity-OrganicSynthesis-NaturalProductPre-clinicalStudies-Physi/chemProperties-Biologicalactivities-Pre-formulationInvestigationalNewDrugApplicationClinicalTrials-PhaseI,II,IIIStudies:-LongtermAnimalToxicity-ProductFormulationDevelopment-ManufacturingandControls-PackageandLabelDesignNewDrugApplication-FDAReview-Pre-approvalInspection-FDAActionPostmarketing-PhaseIVClinicalStudies-AdverseReactionReporting-ProductDefectReporting-ProductLineExtension-PostapprovalCMCChangesAPI品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合NewDrugDevelopmentProcess新药研发程序新化学体•有机合成•天然产品临床前研究•理化特性•生物活性•预制剂研究型新药申请临床试验•I,II,III阶段新药申请•FDA审核•批准前检查•FDA操作市场调查跟踪•IV阶段临床研究•副作用报告•产品缺陷报告•产品线扩展•批准后CMC变更研究:•长期动物毒性研究•产品剂型研发•生产和控制•包装和标签设计API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合申请人(药品研发者)新药申请NDA医学化学药学生物制药学数据统计微生物学CDER审核不立档处理,发拒绝信立档处理该申请吗否是API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合GenericDrugDevelopmentProcess非专利药开发过程1.APIProcessDevelopment(原料药生产工艺开发)2.DosageFormDevelopment(制剂的研发)3.BioequivalentStudy(生物等效性试验)4.ANDAReview(非专利药的审批)-DS&DPmanufacturingsitesCGMPinspectionDS和DP生产现场CGMP检查5.Post-approvalChanges(批准后的生产工艺变更)API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合DrugApplication药品申请NDA(IND)新药Chemistry,Manufacturing,&Controls(CMC)化学性,生产和控制(CMC)AnimalStudies动物试验Bioavailability生物有效性ClinicalStudies临床试验ANDA非专利药Chemistry,Manufacturing,&Controls(CMC)化学性,生产和控制(CMC)Bioequivalence生物等效性API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合Bioavailability(BA)生物有效性21CFR320.1(a)Definedas“therateandextenttowhichtheactiveingredientoractivemoietyisabsorbedfromadrugproductandbecomesavailableatthesiteofaction.““指从医药产品中吸收到的,且能在作用位置产生有效作用的活”性成分或其部分活性成分的比率和范围API品种推荐/ANDA申报和CGMP认证支持/药品出口贸易渠道整合Bioequivalence(BE)生物等效性21CFR320.1(e)Definedas“theabsenceofasignificantdifferenceintherateandextenttowhichtheactiveingredientoractivemoietyinpharmaceuticalequivalentsorpharmaceuticalalternativesbecomesavailableatthesiteofdrugactionwhenadministeredatthesamemolardoseundersimilarconditionsinanappropriatelydesignedstudy.”“指活性成分。。。。。。在经适当设计的研究中,在相似条件下,当给药的摩尔剂量相同时,在药品的对应作用位置,其被”利用的比率和范围没有明显差异API品种推荐/ANDA申报和CGMP认证支持/药品出...