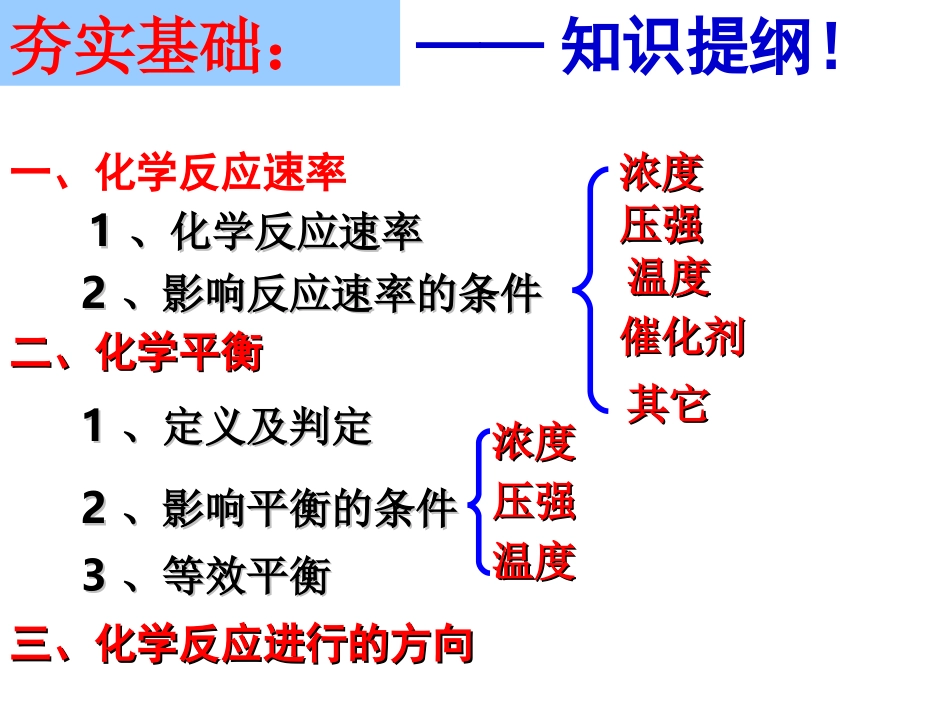
——知识提纲!浓度浓度压强压强温度温度催化剂催化剂其它其它浓度浓度压强压强温度温度一、化学反应速率11、化学反应速率、化学反应速率22、影响反应速率的条件、影响反应速率的条件二、化学平衡二、化学平衡11、定义及判定、定义及判定22、影响平衡的条件、影响平衡的条件33、等效平衡、等效平衡三、化学反应进行的方向三、化学反应进行的方向夯实基础:化学反应速率和化学平衡一、化学反应速率及影响因素二、化学平衡的建立及其判定三、化学平衡的移动及其影响因素四、化学平衡图像问题五、等效平衡六、有关化学平衡的计算七、化学反应进行的方向一、化学反应速率及其影响因素通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。11、概念:、概念:化学反应速率是用来衡量化学反应进行化学反应速率是用来衡量化学反应进行快慢程快慢程度的度的物理量,,2、单位:浓度常用单位:时间常用单位:化学反应速率常用单位:s、min、hmol/Lmol/(L·s)或mol/(L·min)或mol/(L·min)△c(A)=V(A).t△mA(g)+nB(g)==pC(g)+qD(g)3、表示方法:V(A)=△c(A)△t△t=△c(A)V(A)V(A)=△c(A)△t或V(A)==△n(A)V(体积).t△4、特点:⑴、化学反应速率是一段时间内的平均速率,且取正值。⑵、在同一反应中用不同的物质来表示反应速率时其数值可以是不同的,但意义相同。⑶、同一反应、同一时间段内不同物质的速率的比值一定等于化学反应方程式中相应的化学计量数(系数)之比。ひ(A):ひ(B):ひ(C):ひ(D)==m:n:p:q(4)、不能用固态和纯液态物质来表示化学反应进行的快慢;(固态和纯液态物质的浓度为常数)。1、内因:由物质结构和性质决定,非人为因素所能左右!2、外因:a.浓度c.温度b.压强d.催化剂e.其他条件:固体颗粒物的大小、溶剂的性质等(主要)(次要)5、影响化学反应速率的因素外界条件变化情况影响结果事例浓度增大减小温度升高降低压强改变了物质的浓度增大减小未改变物质的浓度增大减小催化剂正催化剂负催化剂加快减慢加快减慢加快减慢无影响无影响大大加快大大减慢稀、浓HNO3与铜的反应食物的腐败2SO2+O22SO≒3一定条件下2SO2+O22SO≒3在体积恒定的密闭容器中进行,向里面通入CO2等其他气体MnO2催化H2O2的分解略外界因数对化学反应速率的影响结果:浓度、压强、温度、催化剂是影是影响响化学反应速率的化学反应速率的四大因素四大因素此外还有光、超声波、激光、放射性、电磁波、反应物的颗粒的大小、扩散速率、溶剂效应等也影响了反应速率。分子运动相互碰撞分子具有足够的能量活化分子有合适的取向有效碰撞发生化学反应——化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。碰撞理论:特别说明:碰撞理论的关键词1、分子碰撞2、活化分子——能发生有效碰撞的分子叫活化分子。3、分子碰撞取向4、有效碰撞——发生化学反应的碰撞叫有效碰撞。活化分子百分数=(活化分子数/反应物分子数)×100%5、活化分子百分数化学反应发生必须满足的条件:1、分子间必须碰撞;2、属于活化分子;3、分子碰撞的取向合适。没合适的取向没足够的能量足够的能量+合适的取向【类比法】借鉴投篮过程。有效碰撞理论外界条件变化情况单位体积内分子数活化分子百分率单位体积内活化分子数单位时间单位体积内有效碰撞数化学反应速率浓度温度外界条件对V影响结果的原因分析:增大增大增加加快减小减小减慢升高不变增加增加降低减少减慢不变不变不变增加增加减少减少减少减少加快×=外界条件变化情况单位体积内分子数活化分子百分率单位体积内活化分子数单位时间单位体积内有效碰撞数化学反应速率压强催化剂增大增加不变增加加快减小减少不变减慢减慢正催化剂负催化剂不变不变减小加快增加增加增加增加减少减少减少减少×=反应条件影响原因影响原因结论结论①增大反应物浓度②增加气体压强③升高温度④合适催化剂(3)、外界条件对化学反应速率影响的原因(活化分子百分数不变)单位体积内分子数增加,活化分子数相应增加。(分子总数不变)反应物分子能量增加,活化分子百分数增加(分子总数不变)降低反应所需的降低反应所需的能量,使活化分子百分数增加能量,使活化分子百分数增加单位体单位...