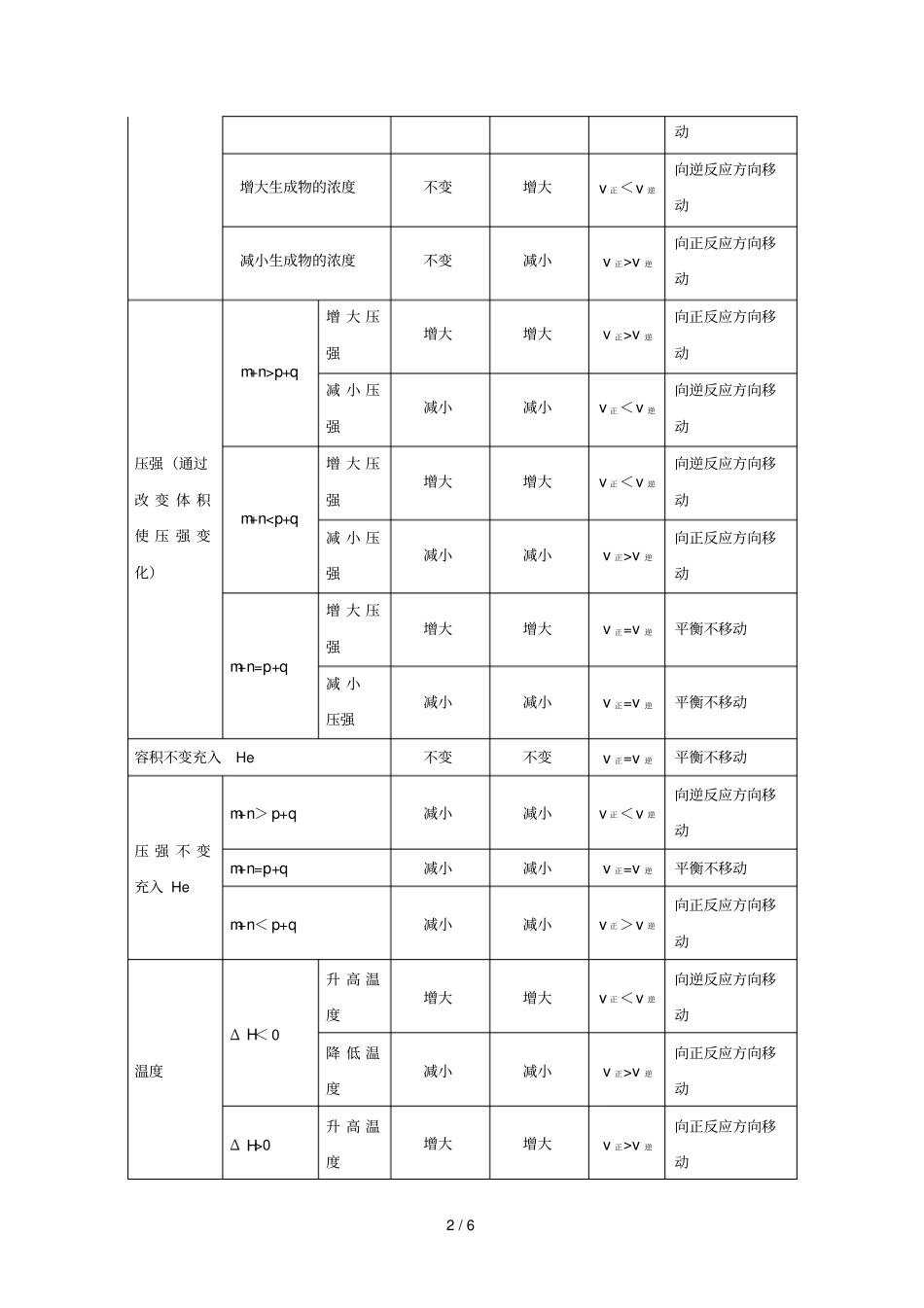
1/6化学平衡移动的分析高考频度:★★★★★难易程度:★★★☆☆将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是A.升高温度,气体颜色加深,则此反应为吸热反应B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍D.恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅【参考答案】C1.外界条件的变化对速率的影响和平衡移动的方向的判断在一定条件下,浓度、压强、温度、催化剂等外界因素会影响可逆反应的速率,但平衡不一定发生移动,只有当v正≠v逆时,平衡才会发生移动。对于反应mA(g)+nB(g)pC(g)+qD(g)。条件改变的时刻v正的变化v逆的变化v正与v逆的比较平衡移动方向浓度增大反应物的浓度增大不变v正>v逆向正反应方向移动减小反应物的浓度减小不变v正<v逆向逆反应方向移2/6动增大生成物的浓度不变增大v正<v逆向逆反应方向移动减小生成物的浓度不变减小v正>v逆向正反应方向移动压强(通过改变体积使压强变化)m+n>p+q增大压强增大增大v正>v逆向正反应方向移动减小压强减小减小v正<v逆向逆反应方向移动m+n
v逆向正反应方向移动m+n=p+q增大压强增大增大v正=v逆平衡不移动减小压强减小减小v正=v逆平衡不移动容积不变充入He不变不变v正=v逆平衡不移动压强不变充入Hem+n>p+q减小减小v正<v逆向逆反应方向移动m+n=p+q减小减小v正=v逆平衡不移动m+n<p+q减小减小v正>v逆向正反应方向移动温度ΔH<0升高温度增大增大v正<v逆向逆反应方向移动降低温度减小减小v正>v逆向正反应方向移动ΔH>0升高温度增大增大v正>v逆向正反应方向移动3/6降低温度减小减小v正<v逆向逆反应方向移动催化剂使用正催化剂增大增大v正=v逆平衡不移动使用负催化剂减小减小v正=v逆平衡不移动2.浓度、压强和温度对平衡移动影响的几种特殊情况(1)改变固体或纯液体的量,对平衡无影响。(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。(3)对于反应前后气体体积无变化的反应,如H2(g)+I2(g)2HI(g),压强的改变对平衡无影响。但增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。(4)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度相当于增大(减小)压强。(5)在恒容容器中,当改变其中一种气态物质的浓度时,必然会引起压强的改变,在判断平衡移动的方向和物质的转化率、体积分数变化时,应灵活分析浓度和压强对化学平衡的影响。1.在容积不变的密闭容器中,一定条件下发生反应:2A(?)B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是A.若正反应是吸热反应,则A为非气态B.若正反应是放热反应,则A为非气态C.在平衡体系中加入少量C,该平衡向逆反应方向移动D.改变压强对该平衡的移动一定无影响2.下列图像能正确地表达可逆反应3A(g)+B(g)2C(g)ΔH<0的是3.温度一定时,在密闭容器中发生可逆反应:mA(气)+nB(气)pC(气),达到平衡后,4/6若将混合气体的体积压缩到原来的1/2,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是A.平衡向逆反应方向移动B.C气体的体积分数增大C.气体A的转化率升高D.m+n>p4.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高5.在一个不导热的密闭反应器中,只发生两个反应:A(g)+B(g)2C(g)ΔH1<0;X(g)+3Y(g)2Z(g)ΔH2>0。进行相关操作且达到化学平衡后(忽略体积改变所做的功),下列叙述错误的是A.等压时,通入惰性气体,C的物质的量不变B.等压时,通入Z气体,反...