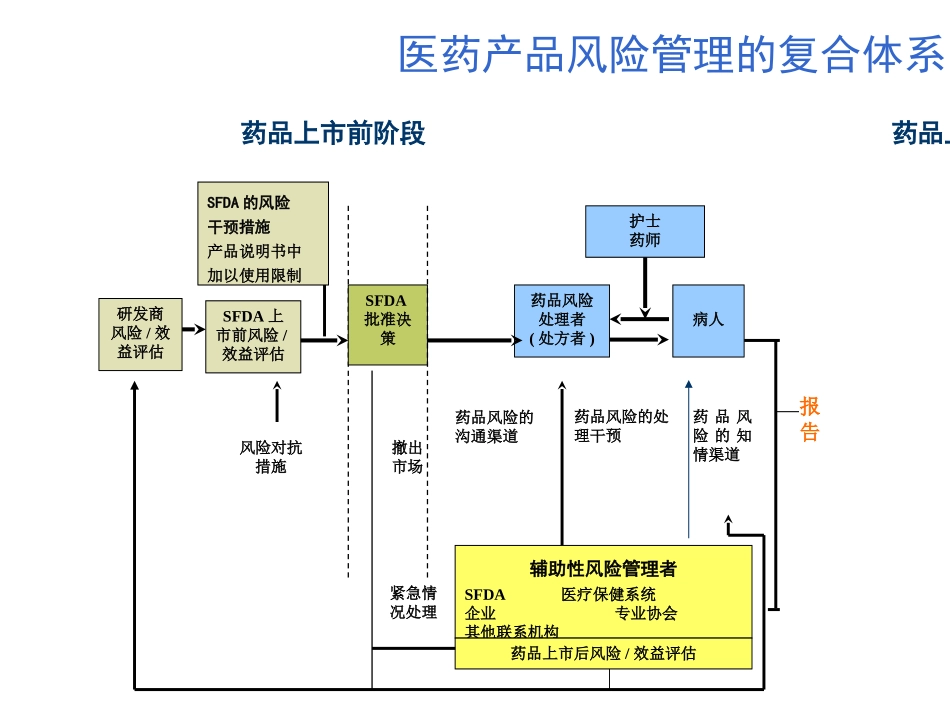
药品不良反应监测工作现状与展望曹立亚国家药品不良反应监测中心2003年11月药品是用于预防、诊断、治疗疾病的特殊商品。特点:双刃剑——风险与效益并存,疗效与不良反应同在,并伴随药品研发和使用全过程。客观必然的规律。人类付出了伤害、伤残、生命代价后才逐渐认识并建立应对方法。研发商风险/效益评估SFDA上市前风险/效益评估SFDA批准决策护士药师药品风险处理者(处方者)病人撤出市场紧急情况处理风险对抗措施药品风险的沟通渠道药品风险的处理干预药品风险的知情渠道辅助性风险管理者SFDA医疗保健系统企业专业协会其他联系机构药品上市后风险/效益评估SFDA的风险干预措施产品说明书中加以使用限制医药产品风险管理的复合体系药品上市前阶段药品上市后阶段报告•药品上市前研究的局限性生物学实验临床试验(病例少;研究时间短;试验对象范围窄;;用药条件控制严格;研究目的单一)药品随经过科学研究和严格审查才被审批上市,但上市后药品依然存在安全风险。药品上市并不表明其绝对安全,也不是安全评价和风险管理的结束,而是要在更广泛使用的情况下,继续安全评价和风险管理。药品不良反应的影响WHO:由于ADR而住院5%;住院患者中ADR发生率10-20%,不发达国家高于发达国家。美国:1998年因ADR致死率仍占所有死因的第4-6位。英国:有5000万人口,每年用于救治ADR受害者的费用可达26亿英磅,约合$39亿。我国5000-8000万残疾人,听力残疾约占1/3,其中60-80%与药物有关,抗生素是致耳龙的主要药物。研发商风险/效益评估SFDA上市前风险/效益评估SFDA批准决策护士药师药品风险处理者(处方者)病人撤出市场紧急情况处理风险对抗措施药品风险的沟通渠道药品风险的处理干预药品风险的知情渠道辅助性风险管理者SFDA医疗保健系统企业专业协会其他联系机构药品上市后风险/效益评估SFDA的风险干预措施产品说明书中加以使用限制医药产品风险管理的复合体系药品上市前阶段药品上市后阶段报告——药品不良反应监测工作的意义发现、预警,降低风险有效手段。监测:发现,报告,评价,控制国际药品不良反应监测1960’反应停事件完善药品监管,加快ADR信息收集系统建立。美欧数国率先建立ADR报告制度。成立WHO药品监测合作计划组织及其他国际监测体系•控制措施:修改说明书;反馈信息;变更注册决定等。例:美国FDA:修改说明书:1976-1985上市新药198种,使用说明书显著修改102个(51.5%);1999年出于安全性原因对约210个化学单体药品的使用说明书进行了修改。撤销:1997-2001撤销10种药:阿洛司琼(8个月);溴芬酸、格帕沙星、右芬氟拉明、米贝拉地尔(1年);曲格列酮、西立伐他汀、阿司咪唑、特非那丁等。撤市案例:阿洛司琼概况:Glaxo公司开发,治疗肠易激综合征2000年2月FDA批准上市;4月在我国申请进口注册2000年11月,Glaxo公司主动将其撤出市场主要不良反应:严重便秘、缺血性结肠炎撤药原因:上市后,70例严重不良反应报告:49例缺血性结肠炎;21例严重便秘。其中:3例死亡;10例需手术治疗;34例住院。上市时间总处方数*总ADR数ADR/1000处方横纹肌溶解**横纹肌溶解发生率(/100000)阿托伐他汀1997561370012920.23100.178西立伐他汀199715306004530.3050.327氟伐他汀199412794003530.0500普伐他汀199035515005900.1710.028辛伐他汀19891478540027430.18310.210撤市案例:西立伐他汀(拜司亭)英国他汀类药物的处方和不良反应的统计数字(1996-2000)*:西立伐他汀和阿托伐他汀从1997年计算**:横纹肌溶解从药物上市开始计算药物名称致死性横纹肌溶解的发生率/每百万张处方辛伐他汀0.12西立伐他汀3.16阿托伐他汀0.04普伐他汀0.04洛伐他汀0.19氟伐他汀0美国AERS数据库与他汀相关的横纹肌溶解的案例情况我国药品不良反应监测我国ADR监测工作相对来说,起步比较晚。八十年代末九十年代初,原卫生部药政局和医政司先后在北京、上海、广东、解放军等共十四个医院进行药品不良反应监测报告工作试点。1989年成立卫生部药品不良反应监察中心。1998年3月我国加入WHO药品监测合作计划,成为其正式成员国之一,并同时开始实施成员国的权力和义务。我国药品不良反应监管体系...