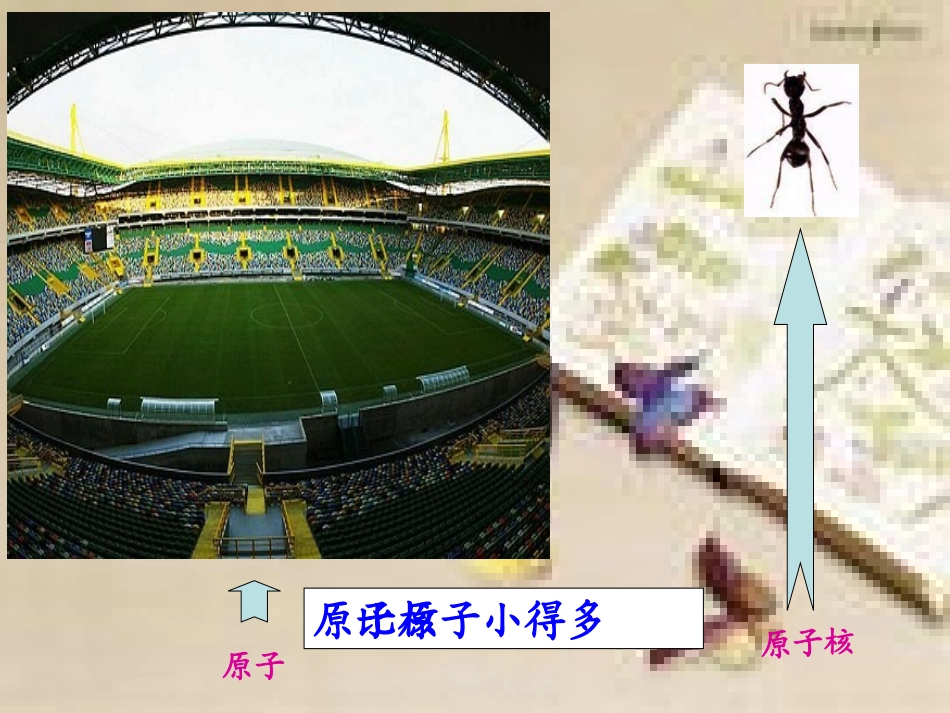
课题2原子的结构Ⅱ原子原子核质子:一个质子带一个单位的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷原子核原子原子核比原子小得多你知道核外电子的排布有什么特点吗?一、核外电子的排布一、核外电子的排布一、核外电子的排布一、核外电子的排布电子层离核由近到远,能量由低到高;共有七层。排布特点排布特点11:电子在核外是分层排布的。:电子在核外是分层排布的。排布特点排布特点22:第一层最多排:第一层最多排22个电子,个电子,第二层最多排第二层最多排88个电子,个电子,最外层电子数最多不超过最外层电子数最多不超过88个。个。电子总是先排在能量最低的电子层里(即第一层排满了才排第二层,依次下去)二、原子结构示意图二、原子结构示意图812+11Na原子核原子核核电荷数(质子数)核电荷数(质子数)第一电子层第二电子层第三电子层电子层上的电子数带正电1-18号元素的电子排布:三、最外层电子数与元素的化学性质的关系三、最外层电子数与元素的化学性质的关系易发生化学反应得电子大于4非金属元素易发生化学反应失电子小于4金属元素相对稳定不得不失8(He为2)稀有气体元素化学性质得失电子最外层电子数元素的分类结论:最外层电子数决定元素的化学性质结论:最外层电子数决定元素的化学性质+17287钠原子Na氯原子Cl+11281钠离子Na+氯离子Cl-+17288+1128Na+Cl-NaCl四、离子的形成钠与氯气反应氯化钠由氯离子和钠离子构成原子失去电子形成得到电子形成阳离子阴离子化合物静电作用形成阳离子:阴离子Na+Mg2+NH4+(铵根离子)Cl-OH-SO42-(硫酸根离子)1、离子的形成2、离子:带电荷的原子或原子团失去2个电子得到2个电子28+12Mg2+2+1686SS2-28+1682+128Mg22+1686S22+128Mg1、在原子中,质子数和电子数有何关系?28+1228+168Mg2+S2-2、在离子中,质子数和电子数又有何关系?原子中,质子数=电子数阳离子中,质子数>电子数阴离子中,质子数<电子数原子阳离子阴离子失电子得电子失电子得电子原子中:质子数=电子数(原子不带电)阳离子中:质子数>电子数(带正电)阴离子中:质子数<电子数(带负电)3原子和离子的联系和区别区别联系:4.离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。离子带1个单位的正电荷或1个单位的负电荷,“1”省略不写。表示:n=1时省略5.离子符号表示的意义:2Mg2+:表示两个镁离子1)表示一个某离子2)表示(带几个单位的正或负电荷的)某离子3)离子符号前面的化学计量数(系数)表示离子的个数;2Mg2+表示每个镁离子带2个单位的正电荷表示2个镁离子例:Mg2+:表示一个镁离子表示(带两个单位的正电荷的)镁离子。表示3个硫离子(带2个单位负电荷)的硫离子。一个硫离子常见离子符号:钾离子钠离子氯离子银离子氢离子镁离子钙离子钡离子铜离子锌离子铝离子铁离子亚铁离子氢氧根离子硫酸根离子硝酸根离子铵根离子碳酸根离子K+Cl-Ag+H+Mg2+Ca2+Ba2+Cu2+Zn2+Al3+Fe3+Fe2+OH-SO42-NO3-NH4+CO32-Na+分子(如O2、H2、H2O)、原子(如汞、金刚石等)、离子(氯化钠:Cl-、Na+等)物质一、核外电子的排布---分层排布二、原子结构示意图掌握1—20号元素的原子结构示意图三、最外层电子数与元素的化学性质的关系最外层电子数与元素的化学性质的关系最外层电子数决定元素的化学性质最外层电子数决定元素的化学性质四、离子的形成四、离子的形成1、定义:带电的原子(或原子团)叫做离子。2、离子的分类:3、离子符号的表示方法4、离子符号表示的意义•1、下列叙述错误的是()•A.分子、原子和离子都能直接构成物质•B.原子中原子核与核外电子的电量相等,电性相反,所以整个原子不显电性•C.决定原子质量大小的主要是质子和电子•D.原子如果得到或失去电子就变成离子•2、分子、原子、离子都是构成物质的离子,下列物质由阴阳离子构成的是()•A.二氧化碳B.黄金C.硫D.氯化钠•3、原子失去电子后,就带上电荷,成为离子;原子得到电子后,就带上电荷,成为离子。当阳离子和阴离子相互作用形成化合物时,整个化合物就电性。CD正阳负阴不显4.下面A、B、C、D四幅图,你知道那幅图是原子结...