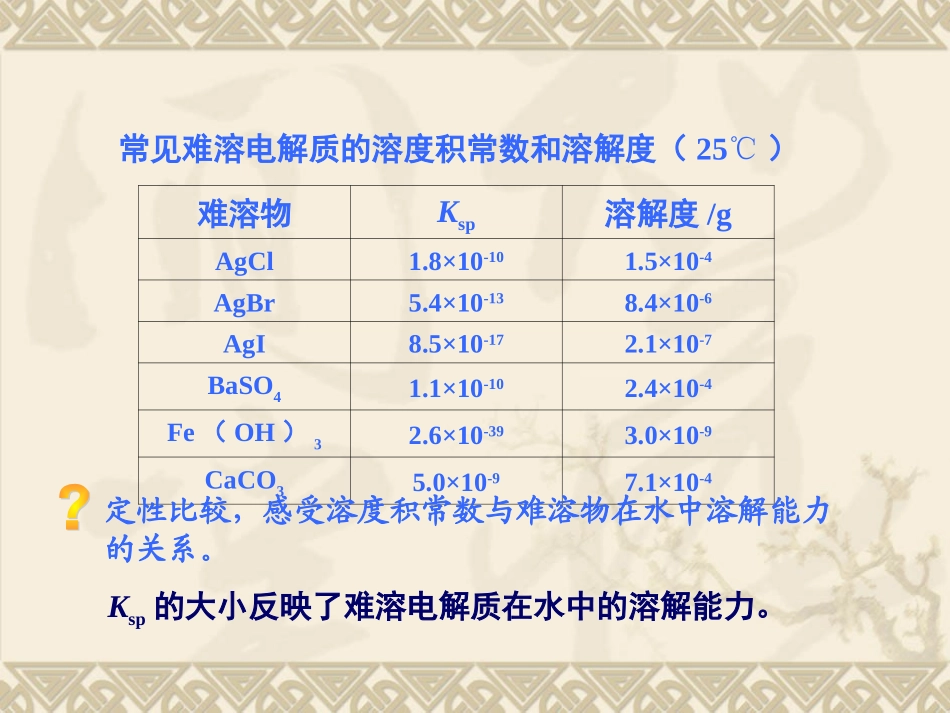
1、定义:2、符号:三、溶度积常数三、溶度积常数难溶电解质的溶解平衡中,离子浓度幂的乘积。Ksp3、影响因素:4、表示方法:只与难溶电解质本身的性质和温度有关。与溶液浓度无关。对于溶解平衡:MmAn(s)mMn+(aq)+nAm-(aq)有:KSP=c(Mn+)m·c(Am-)n难溶物Ksp溶解度/gAgCl1.8×10-101.5×10-4AgBr5.4×10-138.4×10-6AgI8.5×10-172.1×10-7BaSO41.1×10-102.4×10-4Fe(OH)32.6×10-393.0×10-9CaCO35.0×10-97.1×10-4常见难溶电解质的溶度积常数和溶解度(25℃)定性比较,感受溶度积常数与难溶物在水中溶解能力的关系。Ksp的大小反映了难溶电解质在水中的溶解能力。溶度积规则在难溶电解质溶液中,有关离子浓度幂的乘积称为浓度积,用符号QC表示,它表示任一条件下离子浓度幂的乘积。AnBm(s)nAm+(aq)+mBn-(aq)Q=[Am+]n[Bn-]mQC和Ksp的表达形式类似,但其含义不同。Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是QC的一个特例。对某一溶液,当对某一溶液,当(1)(1)QQCC=Ksp=Ksp表示溶液是饱和的。这时溶液表示溶液是饱和的。这时溶液中的沉淀与溶解达到动态平衡,既无沉淀析出又中的沉淀与溶解达到动态平衡,既无沉淀析出又无沉淀溶解。无沉淀溶解。(2)(2)QQCCKsp>Ksp表示溶液处于过饱和状态。有表示溶液处于过饱和状态。有沉淀析出。沉淀析出。以上的关系称溶度积规则(溶度积原理),是平衡以上的关系称溶度积规则(溶度积原理),是平衡移动规律总结,也是判断沉淀生成和溶解的依据移动规律总结,也是判断沉淀生成和溶解的依据。。化学式组成中阴、阳离子个数比相同时,Ksp数值越大,难溶电解质在水中的溶解能力越大。根据KSP的大小比较难溶电解质的溶解能力化学式组成不相同时,利用Ksp计算溶液中的离子浓度来比较难溶电解质的溶解能力例1.已知室温下PbI2的溶度积为7.1×10-9,求饱和溶液中Pb2+和I-的浓度;在c(I-)=0.1mol·L-1的溶液中,Pb2+的浓度最大可达到多少?Ksp=c(Pb2+)·c2(I-)(1)已知溶度积求离子浓度:PbI2(s)Pb2+(aq)+2I-(aq)解:c(Pb2+)=Ksp/c2(I-)=7.1×10-9/0.12=7.1×10-7mol·L-1即:该溶液里允许Pb2+的最大浓度为7.1×10-7mol·L-15.溶度积(Ksp)的应用(2)利用溶度积判断沉淀的溶解与生成例2:将等体积4×10-3mol/L的AgNO3溶液和4×10-3mol/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?[已Ksp(Ag2CrO4)=9.0×10-12]解:等体积混合后,c2(Ag+)×c(CrO42-)=[(4×10-3)/2]2×(4×10-3)/2=8×10-9>9.0×10-12,所以有析出Ag2CrO4沉淀。例3、已知Ksp,AgCl=1.5610-10,试求AgCl溶解度(用g/L表示)解:(1)设AgCl的浓度为c(mol/L),则:AgCl(s)Ag+(aq)+Cl-(aq)平衡cc(3)利用溶度积计算难溶物的溶解度Ksp=C2C=1.2510-5mol/LS=C*M=1.25×10-5mol/L×143.5g/mol=1.79×10-3g/L例4.已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001mol·L-1,c(CO32-)=0.0001mol·L-1,此时Mg2+和CO32-能否共存?(4)利用溶度积判断离子共存:解:c(Mg2+).c(CO32-)=(0.0001)2=1×10-8MgCO3Mg2++CO32-1×10-8<6.82×10-6所以,此时Mg2+和CO32-能共存学以致用医学上救治可溶性钡盐中毒,一般用5.0%的Na2SO4溶液给患者洗胃。c(Ba2+)=(1.1×10-10)/0.38=2.9×10-10(mol/L)因为剩余的c(Ba2+)<10-5mol/L,所以有效除去了误食的Ba2+。已知:Ksp(BaSO4)=1.1×10-10,5%的Na2SO4溶液中的c(SO42-)≈0.38mol/L,请通过计算说明当胃液中的SO42-离子浓度达到该数值时,能否有效解毒呢?资料:当胃中的Ba2+浓度约小于10-4mol/L时,可以达到解毒的目的。1、下列说法正确的是()A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数;B.AgCl的Ksp=1.8×10-10mol·L-1,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol·L-1;C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液;D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。大展...