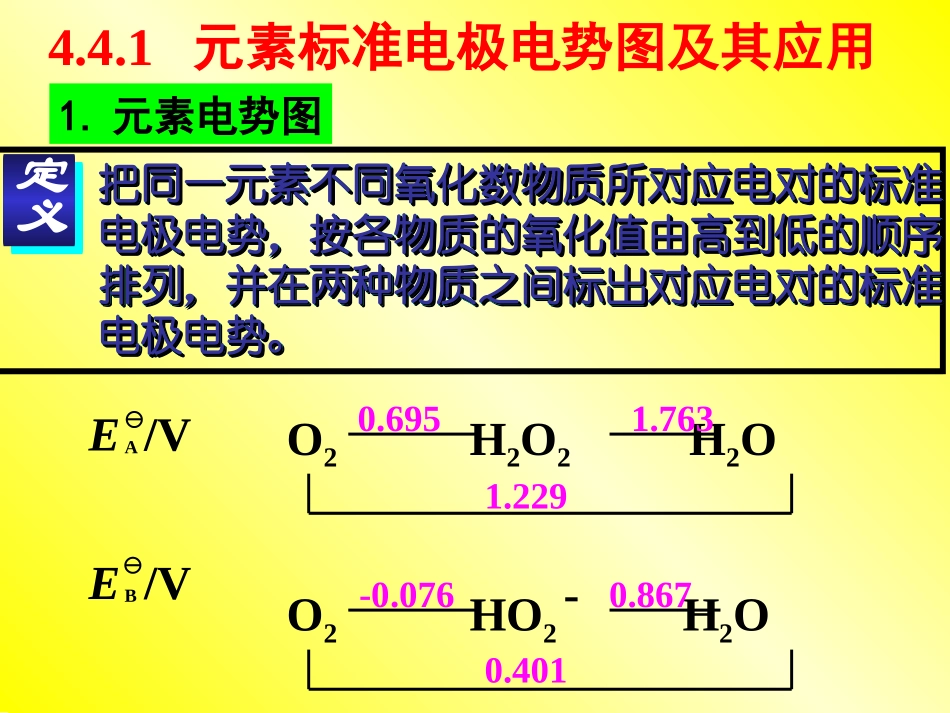
4.44.4电势图及其应用电势图及其应用第第44章章氧化还原反应氧化还原反应把同一元素不同氧化数物质所对应电对的标准把同一元素不同氧化数物质所对应电对的标准电极电势,按各物质的氧化值由高到低的顺序电极电势,按各物质的氧化值由高到低的顺序排列,并在两种物质之间标出对应电对的标准排列,并在两种物质之间标出对应电对的标准电极电势。电极电势。把同一元素不同氧化数物质所对应电对的标准把同一元素不同氧化数物质所对应电对的标准电极电势,按各物质的氧化值由高到低的顺序电极电势,按各物质的氧化值由高到低的顺序排列,并在两种物质之间标出对应电对的标准排列,并在两种物质之间标出对应电对的标准电极电势。电极电势。定义定义4.4.1元素标准电极电势图及其应用O2H2O2H2O0.6951.763A1.229E/VO2HO2H2OEB/V-0.0760.8670.401-1.元素电势图Fe3+Fe2+Fe0.771-0.441-0.037AE/VFe3+/Fe2+Fe2+/FeFe3+/FeFe3++e-Fe2+Fe3++3e-FeFe2++2e-Fe2.应用:2.应用:n、n1、n2、n3分别为各电对中氧化型与还原型的氧化数之差EEEn1n2n3n123EABCDn=n1+n2+n3EE1E2E3①①计算电对的标准电极电势计算电对的标准电极电势=n1+n2+n3nEE1E2E3BrO3-BrO-Br2Br-??1.605=2×0.76-1.6051=0.455V(BrO-/Br2)=12(BrO-/Br-)-(Br2/Br-)EEE6240.760.61例E/VB=n1+n2+n3nEEEE+5+10-111=6×0.61-2×0.764=0.53V(BrO3-/BrO-)=E46(BrO3-/Br-)–2(BrO-/Br-)EE2BrO3-BrO-Br2Br-411?0.4551.6050.760.61E/VB6=n1+n2+n3nEEEE②②判断能否发生歧化反应判断能否发生歧化反应氧化数升高或降低发生在同一物质内同一元素上的反应称为歧化反应歧化反应。。Cl2+H2O→HClO+HCl-10+1当一种元素处于中间氧化数时当一种元素处于中间氧化数时,,它一部分向高它一部分向高的的氧化数状态变化氧化数状态变化((被氧化被氧化),),另一部分向低的氧另一部分向低的氧化化数状态变化数状态变化((被还原被还原)),这类反应称为歧化反,这类反应称为歧化反应应(左)(右)ABC结论:(右)>(左),B易发生歧化反应,产物是A和C。EE(右)<(左),A与C可反歧化为B。EEEE2Cu+→Cu2++CuE(Cu2+/Cu+)=0.159VE(Cu+/Cu)=0.520V>Cu2+Cu+Cu0.1590.5200.340E/VACu+易发生歧化反应0.562.261.70AE/VMnO4-MnO42-MnO2Mn3+Mn2+0.951.511.23Fe+2H+→Fe2++H2↑③③解释元素的氧化还原特性解释元素的氧化还原特性E/VAFe3+Fe2+Fe0.771-0.44如(1)因(Fe2+/Fe)<0,而(Fe3+/Fe2+)>0EE故在非氧化性稀酸故在非氧化性稀酸((如稀盐酸或稀硫酸如稀盐酸或稀硫酸))中中金属铁只能被氧化为金属铁只能被氧化为FeFe2+2+故在非氧化性稀酸故在非氧化性稀酸((如稀盐酸或稀硫酸如稀盐酸或稀硫酸))中中金属铁只能被氧化为金属铁只能被氧化为FeFe2+2+(2)因(O2/H2O)=1.229V>(Fe3+/Fe2+)4Fe2++O2+2H+→4Fe3++2H2O所以Fe2+在空气中不稳定易被空气中氧氧化为易被空气中氧氧化为FeFe3+3+所以Fe2+在空气中不稳定易被空气中氧氧化为易被空气中氧氧化为FeFe3+3+E/VAFe3+Fe2+Fe0.771-0.44EE因Fe2+不会发生歧化反应可发生歧化反应的逆反应可发生歧化反应的逆反应因Fe2+不会发生歧化反应可发生歧化反应的逆反应可发生歧化反应的逆反应在在FeFe2+2+盐溶液,加入少量金属铁盐溶液,加入少量金属铁能避免能避免FeFe2+2+空气中氧气氧化为空气中氧气氧化为FeFe3+3+在在FeFe2+2+盐溶液,加入少量金属铁盐溶液,加入少量金属铁能避免能避免FeFe2+2+空气中氧气氧化为空气中氧气氧化为FeFe3+3+Fe+2Fe3+→3Fe2+如E/VAFe3+Fe2+Fe0.771-0.44④④判断判断氧化还原的产物氧化还原的产物MnO4-MnO21.701.23Mn2+例:已知锰和碘的元素电势图IO3-I21.200.53I-E/VAMnO4-MnO21.701.23Mn2+IO3-I21.200.53I-E/VAMnO4-+I-+2H+→Mn2++IO3-+H2O在酸性溶液中,KMnO4与KI反应MnO4-MnO21.701.23Mn2+IO3-I21.200.53I-E/VA2MnO4-+I-+2H+→2MnO2+IO3-+H2OKMnO4过量KI过量2MnO4-+10I-+16H+→2Mn2++5I2+8H2O第第44章章氧化还原反应氧化还原反应第第44节结束节结束