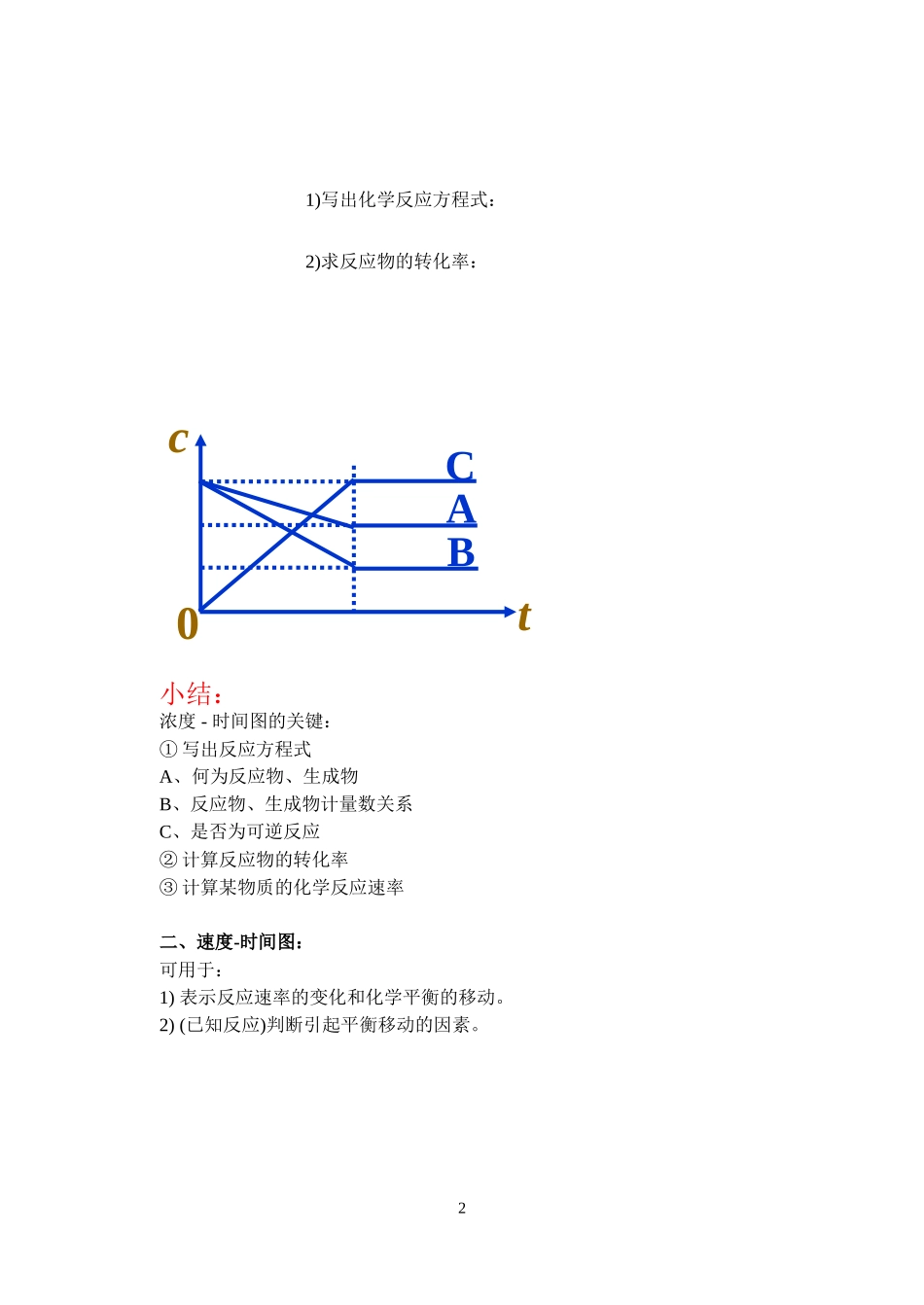
化学平衡中的常见图像浓度-时间图速率-时间图某物质的转化率(或百分含量)-时间-温度(或压强)图某物质的转化率(或百分含量)-温度-压强图图像题是化学平衡中的常见题型,这类题目是考查自变量(如时间、温度、压强等)与因变量(如物质的量、浓度、百分含量、转化率)之间的定量或定性关系。⒈五看图像⑴一看面:即明确横纵坐标的意义;⑵二看线:了解线的走向和变化趋势;⑶三看点:即起点、交点、终点、拐点与极值点‘等;⑷四看辅助线:如等温线、等压线、平衡线等;⑸五看量的变化:如浓度、温度、压强的变化等。⒉分析判断⑴根据到达平衡的时间长短,结合化学反应速率理论判断温度的高低或压强的大小;⑵根据图像中量的变化判断平衡移动的方向,结合平衡移动原理,分析可逆反应的特点(是气体分子数增大还是减小的反应;或是吸热还是放热反应);⑶定一议二:若图像中有三个量,要先固定一个自变量,再讨论另外两个量之间的关系;思维要全面,要注意变换定量与变量,最后下综合结论。一、浓度-时间图:1小结:浓度-时间图的关键:①写出反应方程式A、何为反应物、生成物B、反应物、生成物计量数关系C、是否为可逆反应②计算反应物的转化率③计算某物质的化学反应速率二、速度-时间图:可用于:1)表示反应速率的变化和化学平衡的移动。2)(已知反应)判断引起平衡移动的因素。2tcCAB01)写出化学反应方程式:2)求反应物的转化率:3tvv正v逆t1t20t1t2tvv正v逆0v逆t1t2tvv正0已知对某一平衡改变温度时有如下图变化,则温度的变化是(升高或降低),平衡向反应方向移动,正反应是热反应。对于:mA(g)+nB(g)pC(g)+qD(g),改变压强时有如下图变化,则压强变化是(增大或减小),平衡向反应方向移动,m+n(>、<、=)p+q。A(g)+2B(g)2C(g)引起平衡移动的因素是平衡将向方向移动。解析:由于v正、v逆均有不同程度的增大,引起平衡移动的因素可能是a.升高温度b.增大压强。根据反应方程式,升高温度平衡向逆反应方向移动,与图示相符;增大压强平衡向正反应方向移动,与图示不相符。故此题中引起平衡移动的因素是升高温度。4v逆t1t2tvv正0v逆t1tvv正0对于:A(g)+3B(g)2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。•对于:mA(g)+nB(g)pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。由于v正、v逆相同程度的增大,t1时的改变因素可能是a.加入(正)催化剂,b.当m+n=p+q时增大压强。平衡没有移动。小结:速率-时间图的关键:①看出反应速率的变化②判断化学平衡的移动方向③判断影响化学反应速率和化学平衡的因素三、某物质的转化率(或百分含量)-时间-温度(或压强)图:对于反应mA(g)+nB(g)pC(g)+qD(g)对于反应mA(g)+nB(g)pC(g)+qD(g)5A的转化率T1T2B的转化率P1P2tB%T2P2T1P2T1P10T1>T2;正反应吸热P1
T2;正反应吸热t0t0小结:某物质的转化率(或百分含量)-时间-温度(或压强)图的关键:①判断温度(或压强)的大小②学会“定一议二”法。四、某物质的转化率(或百分含量)-温度-压强图:在以密闭容器中进行的反应mA(g)+nB(g)pC(g)+qD(g)6TA的转化率1.01*107Pa1.01*106Pa1.01*105Pa0PC的浓度500℃200℃0正反应放热m+n>p+qm+n>p+q正反应吸热小结:某物质的转化率(或百分含量)-温度-压强图的关键:学会“定一议二”法,找出条件改变对平衡的影响。7P300℃200℃A%P100℃200℃300℃0对于2A(g)+B(g)C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:A、B物质的转化率B、正反应的速率C、平衡体系中的A%D、平衡体系中的C%m+n=p+q正反应吸热Y0常见易错题讲解1、反应3A(g)3B(?)+C(?);△H<0,随着温度的升高,气体平均相对分子质量有变大趋势,则下列判断正确的是A.B和C可能都是固体B.B和C一定都是气体C.若C为固体,则B一定是气体D.B和C可能都是气体2、在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:2NO2N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1molN2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是A.x>yB.x