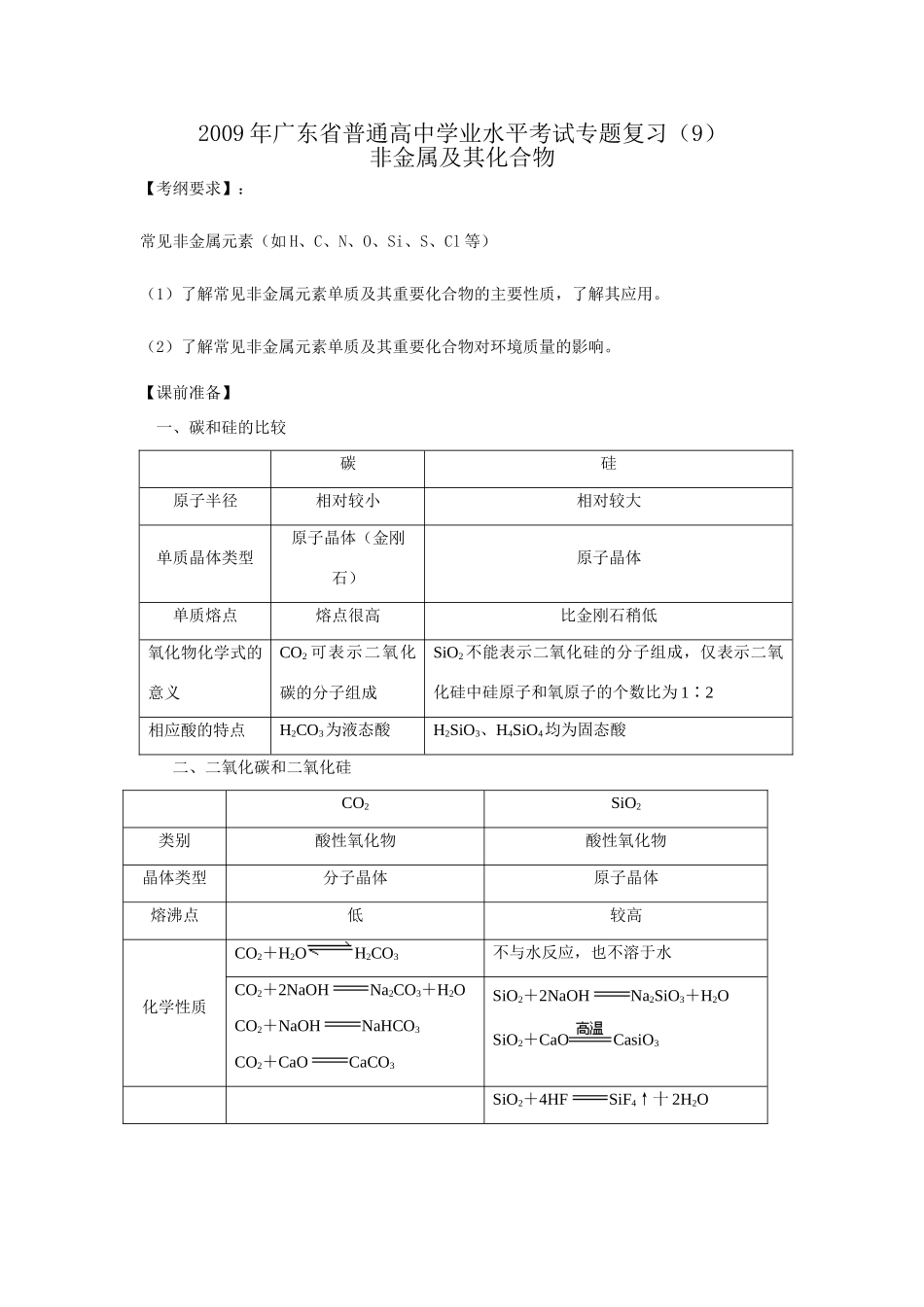
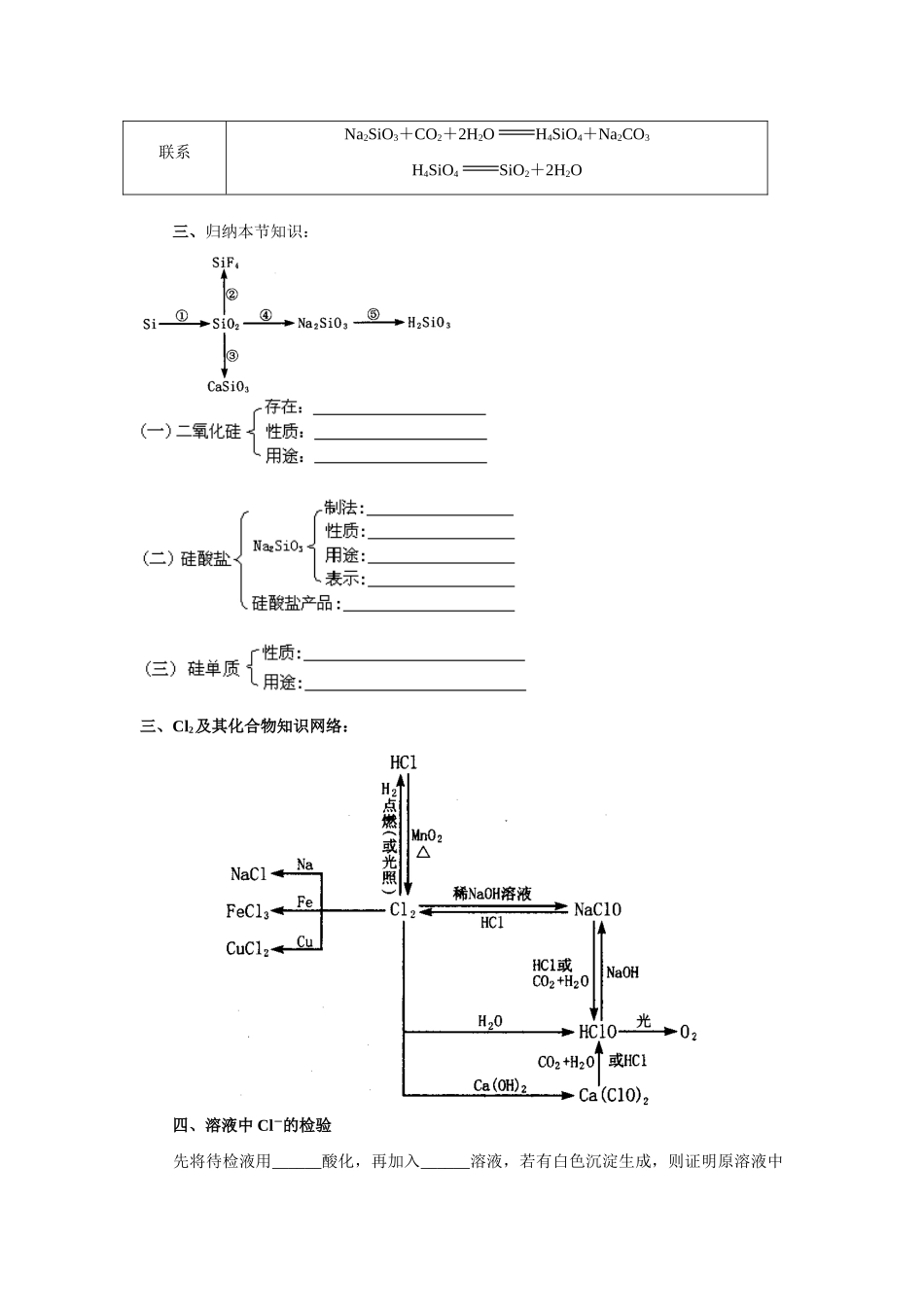
2009年广东省普通高中学业水平考试专题复习(9)非金属及其化合物【考纲要求】:常见非金属元素(如H、C、N、O、Si、S、Cl等)(1)了解常见非金属元素单质及其重要化合物的主要性质,了解其应用。(2)了解常见非金属元素单质及其重要化合物对环境质量的影响。【课前准备】一、碳和硅的比较碳硅原子半径相对较小相对较大单质晶体类型原子晶体(金刚石)原子晶体单质熔点熔点很高比金刚石稍低氧化物化学式的意义CO2可表示二氧化碳的分子组成SiO2不能表示二氧化硅的分子组成,仅表示二氧化硅中硅原子和氧原子的个数比为1∶2相应酸的特点H2CO3为液态酸H2SiO3、H4SiO4均为固态酸二、二氧化碳和二氧化硅CO2SiO2类别酸性氧化物酸性氧化物晶体类型分子晶体原子晶体熔沸点低较高化学性质CO2+H2OH2CO3不与水反应,也不溶于水CO2+2NaOHNa2CO3+H2OCO2+NaOHNaHCO3CO2+CaOCaCO3SiO2+2NaOHNa2SiO3+H2OSiO2+CaOCasiO3SiO2+4HFSiF4↑十2H2O联系Na2SiO3+CO2+2H2OH4SiO4+Na2CO3H4SiO4SiO2+2H2O三、归纳本节知识:三、Cl2及其化合物知识网络:四、溶液中Cl-的检验先将待检液用______酸化,再加入______溶液,若有白色沉淀生成,则证明原溶液中有_______存在。若原溶液中可能含有SO,则应先加入_______溶液以除去SO。五、碳和氮的氧化物六、稀硫酸具有酸的通性,浓硫酸除具有酸的通性外,还具有吸水性、脱水性、强氧化性三大特性。浓H2SO4SO2Fe、Al等金属常温下在浓硫酸中钝化,金属与浓硫酸反应不能得到H2。七、硝酸具有强氧化性Fe、Al等金属常温下在浓硝酸中钝化,金属与硝酸反应得不到H2。八、【课堂复习】知识点1:碳及其化合物例1、在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断水溶液中含有()A.Cl-,SOB.Cl-,NOC.Cl-,COD.Cl-,OH-知识点2:硅及其化合物例2、下列说法正确的是()A.SiO2溶于水显酸性B.CO2通入水玻璃可得硅酸C.SiO2是酸性氧化物,它不溶于任何酸D.SiO2晶体中不存在单个SiO2分子例3、证明生石灰中既混有石英,又混有石灰石的正确方法是()A.加入过量的盐酸,观察是否有气泡冒出B.加入过量的烧碱溶液,观察是否有固体溶解C.加热至高温,观察是否有气泡冒出,是否有硅酸钙生成D.先加过量的盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有不溶物则滤出,投入到氢氧化钠溶液中看其是否溶解知识点3:氯及其化合物例4、下列叙述中能证明次氯酸是一种弱酸的是()A.次氯酸不稳定,易分解B.次氯酸是一种强氧化剂C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸D.次氯酸能使染料和有机色质褪色例5、具有漂白作用的物质有①次氯酸②二氧化硫③活性炭④过氧化钠,其漂白原理相同的是()A.①③B.②③C.①④D.②④知识点4:硫及其化合物例6、为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中()A.饱和烧碱溶液B.饱和小苏打溶液C.饱和纯碱溶液D.浓硫酸例7、下列物质放于水中,没有发生氧化还原反应的是A.SO2溶解于水B.NO2溶解于水C.Cl2溶解于水D.NH3溶解于水例8、下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有()A.SO2、O2、N2B.HCl、Cl2、CO2C.CH4、H2、COD.SO2、Cl2、O2知识点5:氮及其化合物例9、在下列反应中,HNO3既表现出氧化性,又表现出酸性的是()A.H2S+2HNO3S↓+2NO2↑十2H2OB.CuO+2HNO3Cu(NO3)2十H2OC.4HNO34NO2↑十O2↑十2H2OD.3Cu+8HNO33Cu(NO3)2+2NO↑十4H2O例10、从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是()A.铜和浓硝酸反应B.铜和稀硝酸反应C.氧化铜和硝酸反应D.氯化铜和硝酸银反应【课后作业】1.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是A.肯定没有NO2B.肯定有SO2和NOC.可能有Cl2和O2D.不能确定O2是否存在2、下列反应中气体既做氧化剂又做还原剂的是A.Cl2通入水中B.Cl2通入水Na2SO3溶...